
(10分)研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=_____________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_____________α1(填“>”“<”或“=”),平衡常数K2___________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是____________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年海南华侨中学高二上会考模拟化学试卷(解析版) 题型:选择题
电解质是一类在水溶液里或熔融状态下能够导电的化合物.下列物质属于电解质的是
A.Cu B.K2SO4 C.MgCl2溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中进行反应:X2(g)+Y2(g) 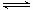 2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Y2为0.15mol/L B.Z为0.2mol/L
C.X2为0.3mol/L D.Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:选择题
下列对有关概念的叙述正确的是
A.在氧化还原反应中,氧化剂得电子还原剂失电子
B.胶体的微粒直径在10-100nm之间,能发生丁达尔现象
C.非金属氧化物为酸性氧化物,金属氧化物为碱性氧化物
D.能导电的物质不一定是电解质,也有可能是非电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期9月月考化学试卷(解析版) 题型:选择题
下列物质中,含原子数最多的是
A. 0.1mol氯化氢 B. 0.4g甲烷
C. 3.4gH2S D. 6.02×1022个氢分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:选择题
已知298.15 K时,可逆反应:(aq)+Sn(s) Pb(s)+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
Pb(s)+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次联考化学试卷(解析版) 题型:选择题
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+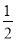 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+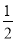 O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.②③④ C.④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:实验题
(8分)为证明Na2O2可作为潜水艇的供氧剂,某化学小组在实验室模拟CO2与Na2O2反应产生氧气的实验。
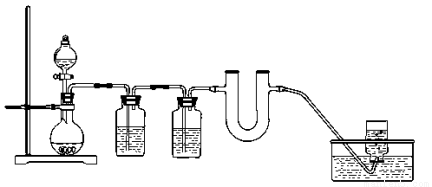
(1)生成CO2的化学反应方程式:
(2)饱和碳酸氢钠溶液的作用是除去CO2中混有的HCl气体,浓H2SO4的作用是
(3)u形管中的现象是 ,反应方程式为
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第三次月考化学试卷(解析版) 题型:实验题
(16分)氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下:
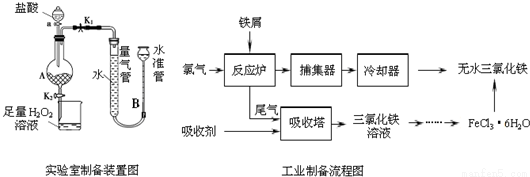
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com