
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:
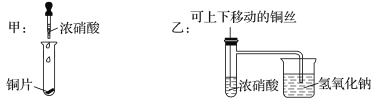
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是__________________________________。
(2)和甲装置相比,乙装置的优点是①______________________;②________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞________,再打开活塞________,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该_______________________。
【答案】Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 可以控制反应的发生和停止 吸收NO2气体,防止污染环境 c ab 先关闭b,再关闭a,然后打开c,用手捂住试管②
【解析】
铜和浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,根据题目给定的装置图可知乙装置有尾气处理装置,同时可以通过移动铜丝来控制反应的发生与停止。实验丙中,实验时先关闭活塞c,再打开活塞a,b,才能使NO2气体充满②试管,当气体充满②试管后,将铜丝提起与溶液脱离停止反应。欲使烧杯中的水进入②试管应该先关闭b,再关闭a,然后打开c,用手捂住试管②。
(1)三个装置中共同发生的反应的化学方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
(2) 和甲装置相比,乙装置的优点是:乙装置有尾气处理装置,同时可以通过移动铜丝来控制反应的发生与停止,故答案为:可以控制反应的发生和停止;吸收NO2气体,防止污染环境。
(3)实验丙中,实验时先关闭活塞c,再打开活塞a,b,才能使NO2气体充满②试管,当气体充满②试管后,将铜丝提起与溶液脱离,停止反应。欲使烧杯中的水进入②试管,应该先关闭b,再关闭a,然后打开c,用手捂住试管②,气体膨胀,当二氧化氮与水接触后发生反应,气压减小,可以把水吸入试管②,故答案为:c ;ab ;先关闭b,再关闭a,然后打开c,用手捂住试管②。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气的分子数为0.1NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C.将含3NA个离子的Na2O2固体溶于水配成1 L溶液,所得溶液中Na+的浓度为2 mol·L-1
D.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
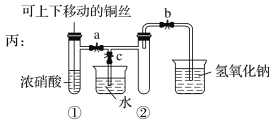
【题目】下图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
X | Y | Z | |
A | CuSO4·5H2O | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | 碱性氧化物 | 氧化物 | 化合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水反应生成一种氯化 物和两种氮化物,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①仪器M的名称为_____.
②制备NO发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式: ________.
③欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a->______(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOC1,装置如下图所示。操作为:检验装置气密性并装入药品,打开K2,然后再打开K3通入一段时间气体Cl2,然后进行其他操作,当Z有一定量液体生成时, 停止实验。
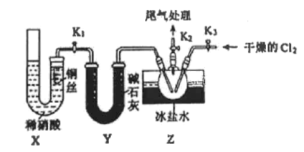
①实验室也可用X装置制备NO,相对甲组同学的气体发生装置,X装置的优点为______.
②若无装置Y,则Z中NOC1可能发生反应的化学方程式为____.
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用 cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是________;亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)= 1.56×10-10, Ksp(Ag2CrO4)=l×l012]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以MezTeCMe表 示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。
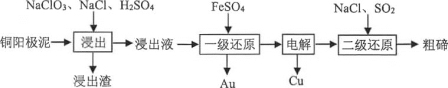
①浸出液的主要成分为CuSO4、HAuCu、H2TeO3,则浸出渣的主要成分 为____(填化学式);“浸出”过程中有少量污染性气体生成,该气体是_______(填物质名称)
②已知HAuCU是一种强酸,则“一级还原”过程中发生反应的离子方程式为_________。
③欲得到64g碲,则“二级还原”过程中至少需通入____mol SO2。 “氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3和Cu(OH)2,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为______。
②电解过程中,阴极的电极反应式为______。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是____(任写一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
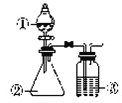
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价——物质类别关系图如下。
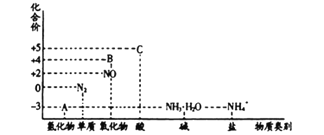
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是:__________
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式: _______________;
(3)实验室中,检验溶液中含有NH4+的操作方法是: __________________________;
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式_____________,当反应消耗3.36L (标准状况) 物质B时,转移电子的物质的量为__________________________。
(5)将32g铜与140 mL一定浓度的C溶液反应,铜完全溶解产生的气体在标准状况下的体积为11.2L。
①参加反应的C的物质的量为__________________________;
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1 的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原C溶液的浓度为________ mol·L-1
③欲使铜与C反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通入O2_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,2.24LH2O含有的分子数为0.1NA
B.常温常压下,1.06gNa2CO3含有的Na+数目为0.02NA
C.0.1mol/L的MgCl2溶液中,含有Cl-数目为0.2NA
D.将0.lmolNaCl粉末分散于乙醇中制成胶体,则其中含有的胶体粒子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 由中科院等离子体物理研究所自主研制的全超导托卡马克实验装置(俗称“人造太阳”)正在接受技术升级。人造太阳是利用氘、氚核聚变反应释放巨大能量原理而实现的。下列说法正确的是________。
A.氕、氘、氚三种元素在周期表中的位置不同
B.20 g D2O含有的中子数为6.02×1024个
C.在隔绝空气和高温下LiCl与金属钠反应可获得金属锂
Ⅱ. 部分元素在周期表中的位置如下:
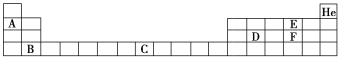
请回答下列问题:
(1)元素C在周期表中的位置为________。
(2)判断E和F对应的简单氢化物沸点高低,并解释原因____________。
(3)用电子式表示F的氢化物的形成过程:___________。
Ⅲ.溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:
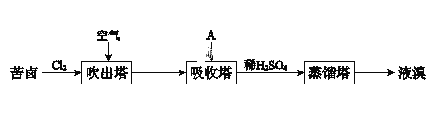
(1)结合元素周期律解释Cl的非金属性强于Br的原因:_______________。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br和BrO3,则A是________(填序号)。
A.NaCl溶液 B.Na2CO3溶液 C.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com