
【题目】根据表中提供的数据(25 ℃),判断下列说法正确的是
化学式 | 电离常数 |
HClO | Ka=3.0×10-8 |
H2CO3 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
A. 向氯水中加入硫酸,可增强杀菌效果
B. 温度升高,次氯酸的电离常数增大
C. 25 ℃时,ClO-的水解常数为3.0×10-6
D. 要提高氯水中HClO的浓度,可加入足量的Na2CO3固体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NaC1O2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 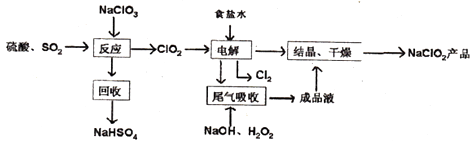
回答下列问题:
(1)“电解”所用食盐水由粗盐水精制而成,精制对,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 .
(2)写出“反应”步骤中生成ClO2的化学方程式 .
(3)实验所用原料硫酸是由浓硫酸稀释而获得,写出实验过程 .
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 .
(5)将lmolSO2和lmolC12通入水中形成lL的溶液,所得溶液中氢离子浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,有关这四种元素的说法一定正确的是
元素 | X | Y | Z | W |
原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A. Z处于元素周期表中第2周期VIA族
B. X、Y都可与氧元素形成多种氧化物
C. Y的氢化物与W的氢化物反应生成的产物中只含有共价键
D. X与W形成的化合物的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
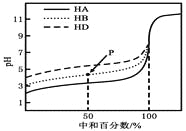
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.铝的金属活泼性强,可用于制作铝金属制品
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.氢氧化铝受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中Cl-的物质的量浓度最大的是
A. 0.5L 0.1mol/L的NaCl溶液 B. 100mL 0.2mol/L的MgCl2溶液
C. 1L 0.2mol/L的AlCl3溶液 D. 1L 0.3 mol/L盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体、浊液三种分散系的本质区别是( )
A. 分散质粒子直径大小 B. 是否有丁达尔效应
C. 是否均一、稳定、透明 D. 是否能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________;该反应能量转化的主要方式为_________。
②反应4的热化学方程式为2H2SO4(l)![]() 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l)![]() SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g)![]() 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________(填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________。
③下列有关图像一定正确的是__________(填字母)。

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________(填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com