
【题目】室温下,pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH值
A. 一定小于7 B. 一定等于7 C. 一定大于7 D. 无法判断
科目:高中化学 来源: 题型:
【题目】填空:
(1)NH3+O2 ![]() NO+H2O,该反应中氧化剂是 , 被氧化的元素是 , 氧化产物是。
NO+H2O,该反应中氧化剂是 , 被氧化的元素是 , 氧化产物是。
(2)若有1 mol O2参加,则反应中转移电子是mol。
(3)配平该反应方程式并用单线桥标出电子转移的方向和数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.AlCl3溶液和过量氨水生成Al(OH)3B.Mg在CO2中燃烧生成MgCO3
C.Fe(OH)3溶于氢碘酸生成FeI3D.SiO2与H2O反应生成H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是( )
A.等物质的量的H2O与D2O含有的中子数
B.等质量的SO2和SO3中含有氧原子数
C.同温同压下,同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质正确的是( )
A.分子中所有原子在同一平面上B.与HCl加成只生成一种产物
C.能使KMnO4酸性溶液褪色D.能与溴水发生取代反应而使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和铁的各种化合物在日常生活中有着广泛应用,请结合所学知识回答下列问题:
(1)已知1g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24kJ热量,请写出H2S气体燃烧热的热化学方式: .
(2)已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32﹣) 且H2SO3 的电离平衡常数为:K1=1.5×10﹣2 K2=1.1×10﹣7;氨水的电离平衡常数为K=1.8×10﹣2; (i)则等物质的量浓度的下列三种溶液:①NH3H2O ②KHSO3 ③KHCO3 溶液中水的电离程度由大到小排列顺序为
(ii)0.1molL﹣1的NaHSO3溶液中C(H+)C(OH﹣)(“>”、“<”或“=”):
(3)已知25℃时Ksp[Cu(OH)2]=2.2×10﹣20 , Ksp[Fe(OH)2]=8.0×10﹣16 , KspFe(OH)3]=4.0×10﹣38 , Ksp[Al(OH)3]=1.1×10﹣33(i)在25℃下,向浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式).
(ii)向1.0mol Fe2(SO4)3和1.0mol FeSO4的1L酸性混合溶液通入NH3 , 至该溶液的PH为3时,所得溶液中c(Fe2+):c(Fe3+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO47H2O)的工业流程示意图如图: 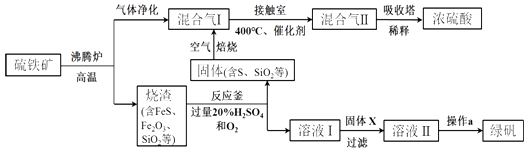
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 .
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 .
(3)反应釜中,烧渣经过反应转化为溶液I和固体. ①烧渣中的FeS在反应中做剂(填“氧化”或“还原”).
②溶液I中所含溶质的化学式是
(4)操作a的主要步骤是:加热浓缩、、过滤洗涤.
(5)流程中,固体X可以选择硫铁矿(FeS2)或;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整: FeS2++═Fe2++SO42﹣+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42﹣、Mg2+、A13+、Fe2+) 经下列流程可制得高纯度硫酸铜晶体如图1: 
已知:该实验条件下,各金属离子沉淀的pH如图2所示.下列判断正确的是( )
A.沉淀1的主要成分为Al(OH)3和Fe(OH)3
B.溶液2中所含金属阳离子只有Mg2+
C.将溶液3蒸干即得CuSO45H2O晶体
D.若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com