
根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是( )
|


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
根据下表中部分短周期元素的原子半径及主要化合价信息,
|
查看答案和解析>>
科目:高中化学 来源:2014届北京市朝阳区高一下学期期末统一考试化学试卷(解析版) 题型:选择题
根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.075 |
0.102 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+5、+3 |
+6、-2 |
-2 |
A. 离子半径: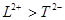
B. 氢化物的还原性:
C. M与T形成的化合物只能与盐酸反应,不与 溶液反应
溶液反应
D. 一定条件下,T的单质可将Q从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.075 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +5、+3 | +6、-2 | -2 |
| A.离子半径:L2+>T2- |
| B.氢化物的还原性:H2T>H2R |
| C.M与T形成的化合物只能与盐酸反应,不与NaOH溶液反应 |
| D.一定条件下,T的单质可将Q从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市朝阳区高一(下)期末化学试卷(解析版) 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.075 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +5、+3 | +6、-2 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com