
【题目】根据要求填空:
(1)相对分子质量为72且沸点最低的烷烃的结构简式为___
(2)写出有机物的键线式:![]() ___
___
(3)写出有机物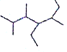 的名称___
的名称___
(4)写出甲基电子式:___,乙炔的结构式___
(5)某有机高分子化合物的结构片段如下:
![]()
则合成它的单体是(写结构简式)___
【答案】C(CH3)4 ![]() 2,3,5-三甲基-4-乙基庚烷
2,3,5-三甲基-4-乙基庚烷 ![]() H-C≡C-H CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2
H-C≡C-H CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2
【解析】
(1)根据烷烃的通式分析其分子式。
(2)根据键线式的书写方法,即省略元素符号,只表示碳原子之间的化学键进行分析。
(3)根据有机物的系统命名方法分析。
(4)根据原子的最外层电子数书写其电子式。
(5)根据加聚反应的特征分析其单体。
(1)相对分子质量为72且沸点最低的烷烃根据烷烃的通式CnH2n+2分析,有12n+2n+2=72,解n=5,根据支链越多沸点越高分析,沸点最低的结构简式为C(CH3)4;
(2有机物![]() ,将碳碳双键写成两条线,单键写成一条线,碳原子和氢原子等都省略,键线式为
,将碳碳双键写成两条线,单键写成一条线,碳原子和氢原子等都省略,键线式为 ![]() ;
;
(3)有机物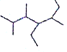 的最长碳链为7个碳原子,从左侧开始编号,得到的名称为2,3,5-三甲基-4-乙基庚烷;
的最长碳链为7个碳原子,从左侧开始编号,得到的名称为2,3,5-三甲基-4-乙基庚烷;
(4)甲基中碳原子周围有7个电子,其电子式:![]() ,乙炔的结构式为H-C≡C-H;
,乙炔的结构式为H-C≡C-H;
(5)某有机高分子化合物的结构片段如下:
![]()
根据双键加成后变成单键分析,第一二碳原子之间是双键,则第二个碳原子和第三个碳原子断开,依次分析,双键变回单键,单键变双键,则合成它的单体为CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2。


科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①
这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①![]() 试纸检验,溶液的
试纸检验,溶液的![]() ②取少量原溶液,向溶液中加入过量的
②取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入
和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙色,用分液漏斗分液④向分液后的水溶液中加入
层呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀产生⑤在滤液中加入
溶液,有白色沉淀产生⑤在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
A.肯定不存在的离子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的离子是![]() 、
、![]() 、
、![]()
C.无法确定原溶液中是否存在![]() 和
和![]()
D.若步骤④改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响
和盐酸的混合溶液,则对溶液中离子的判断也无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴环己烯(![]() )可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
)可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
A.与①反应后的有机产物只有一种
B.与②的反应原理类似于烯烃使溴水褪色
C.与③反应后得到的有机产物可被氧化为醛
D.与④反应后得到的有机产物只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:
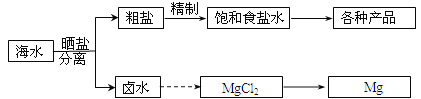
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是________________。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为______,制取它的化学方程式为__________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl26H2O;
d.将MgCl26H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为______________。
②步骤d中的“一定条件”指的是___________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?__________(填“同意”或“不同意”),请说出你同意或不同意的理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol;
C(s)+O2(g)=CO(g) △H=-110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式_________。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=-91kJ/mol
CH3OH(g) △H=-91kJ/mol
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是________
A.2molCO和4molH2 B.2molCO、1molCH3OH和4molH2
C.4molCO和4molH2 D.4molCO和6molH2
②将1molCO和2molH2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,若在相同条件下,起始时在该容器中充入CH3OH(g),反应达到平衡时的热量变化是______(填“吸收”或“放出”)_______kJ热量。
Ⅱ.在1.0L恒容密闭容器中放入0.10molA(g),在一定温度进行如下反应。
A(g)![]() 2B(g)+C(g)+D(s) △H=+85.5kJ/mol
2B(g)+C(g)+D(s) △H=+85.5kJ/mol
容器内气体总压强(p)与起始压强p0的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。

回答下列问题:
(3)下列能提高A的转化率的是___。
A.升高温度 B.向体系中通入A气体
C.减少D的物质的量 D.向体系中通入稀有气体He
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围_________。
(5)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时B的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A 气体和2mol B 气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g) B(g) 2C(g) 。若经 2s 后测得C 的浓度为 0.6mol·L-1,现有下列几种说法:
①用物质A 表示的反应平均速率为 0.3mol·L-1·s-1
②用物质B 表示的反应的平均速率为 0.6mol·L-1·s-1
③2s 时物质A 的转化率为 70%
④2s 时物质B 的浓度为 0.7mol·L-1
其中正确的是( )
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识与技能考查
(1)Na2S2O3与稀硫酸反应(化学方程式):___;
(2)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,写出相关离子方程式:___;
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是___。(填写化学式,只填一种即可)
(4)碳酸氢钠溶液中:比较c(H2CO3)___c(CO32-)(答>,<,=)
(5)常温下,将0.1mol/L盐酸和0.1mol/L的NaOH按体积比11:9混合后,溶液的pH为___;
(6)写出碳酸钠溶液的物料守恒___;在2mol/L的氨水中,加入等体积1mol/L的盐酸,写出质子守恒(水的电离守恒):___;
(7)如图是甲烷燃料电池原理示意图,回答下列问题:电池的负极是___(填“a”或“b”)极,该极的电极反应式是___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com