
����Ŀ����ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õIJ�������ͼ���£�
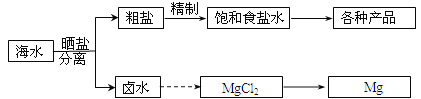
�ش��������⣺
��1����NaCl��ԭ�Ͽ��Եõ����ֲ�Ʒ
�ٹ�ҵ����NaCl�Ʊ������ƵĻ�ѧ����ʽ��________________��
��ʵ�����ö��Ե缫���200mLNaCl��Һ���������������õ�224mL���壨��״��������������Һ��pHΪ_________�����Է�Ӧǰ����Һ������仯����
�۵���Ȼ���ϡ��Һ���Ʊ���84������Һ����84������Һ����Ч�ɷ�Ϊ______����ȡ���Ļ�ѧ����ʽΪ__________________________��
��2����������κ��±ˮ���̺��ŷḻ��þ��Դ����ת����ɻ��MgCl2�ֲ�Ʒ����±ˮ����ȡþ�IJ���Ϊ��
a�������ߴ������ڵı������ճ�ʯ�ң�����ʯ���Ƴ�ʯ���飻
b����ʯ������뵽��ˮ�������о����˵õ�Mg(OH)2������
c����Mg(OH)2�����м�������õ�MgCl2��Һ���پ������ᾧ�õ�MgCl26H2O��
d����MgCl26H2O��һ�������¿��Եõ���ˮMgCl2��
e��������ڵ�MgCl2�ɵõ�Mg��
��������ȡþ������c�У��õ�MgCl2��Һ�����ӷ���ʽΪ______________��
�ڲ���d�е���һ��������ָ����___________________��
����ͬѧ��Ϊ������b��ɼ���Mg(OH)2�õ�MgO���ٵ�����ڵ�MgO�ƽ���þ�������ɼ�ʵ�鲽�裬����ʵ��ļ�Լ��ԭ����ͬ���ͬѧ���뷨��__________������ͬ����������ͬ����������˵����ͬ���ͬ�������______________��
���𰸡�2NaCl�����ڣ�![]() 2Na+Cl2�� 13 NaClO NaCl+H2O
2Na+Cl2�� 13 NaClO NaCl+H2O![]() NaClO+H2�� Mg(OH)2+2H+= Mg2++2H2O ��HCl�����м��� ��ͬ�� ��ΪMgO�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ�
NaClO+H2�� Mg(OH)2+2H+= Mg2++2H2O ��HCl�����м��� ��ͬ�� ��ΪMgO�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ�
��������
��1�������ƱȽϻ��ã���ȡʱֻ�ܲ��õ��ķ���������ʽΪ��2NaCl�����ڣ�![]() 2Na+Cl2�����ڵ�ⱥ��ʳ��ˮ�������õ������������õ����������������ʵ���Ϊ��
2Na+Cl2�����ڵ�ⱥ��ʳ��ˮ�������õ������������õ����������������ʵ���Ϊ��![]() =0.005mol����2NaCl+2H2O
=0.005mol����2NaCl+2H2O![]() Cl2��+H2��+2NaOH ��֪��Cl2����H2����2NaOH����n��NaOH��=2n��Cl2��=2��0.005mol=0.01mol��c��NaOH��=
Cl2��+H2��+2NaOH ��֪��Cl2����H2����2NaOH����n��NaOH��=2n��Cl2��=2��0.005mol=0.01mol��c��NaOH��=![]() =0.1mol/L������pH=13��
=0.1mol/L������pH=13��
����84������ҺΪ����������Һ������Ȼ�����Һ��ȡ�������Ƶķ���ʽΪ��NaCl+H2O![]() NaClO+H2��
NaClO+H2��
��2������Mg(OH)2�����м�������õ�MgCl2��Һ��������Ӧ�����ӷ���ʽΪMg(OH)2+2H+= Mg2++2H2O��
��MgCl26H2O��һ�������¼��ȵõ���ˮMgCl2����ֱ�Ӽ���MgCl26H2O����ٽ�Mg2+ˮ�⣬�ò�����ˮMgCl2����Mg2+ˮ������ԣ�����������Ȼ��������п�����Mg2+ˮ�⣬��һ������Ϊ��HCl�����У�Ŀ��������Mg2+ˮ�⣻
������þ�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ����ʲ�ͬ���ͬѧ���뷨��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʵ�����һ������ȷ����
A. ��FeCl2��Һ�еμ�NH4SCN��Һ����Һ�Ժ�ɫ
B. KAl(SO4) 2��12H2O����ˮ���γ� Al(OH)3����
C. NH4Cl��Ca(OH)2��ϼ��ȿ�����NH3
D. Cu��FeCl3��Һ��Ӧ������CuCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʪ���Ʊ������һ�ֹ����������£�

��֪��������Ҫ�ɷ�ΪCa5(PO4)3(OH)��������Ca5(PO4)3F���л�̼�ȡ�
�ܽ�ȣ�Ca5(PO4)3(OH)<CaSO4��0.5H2O
��1�������������ܼӿ췴Ӧ���ʵĴ�ʩ��__________��
��2����������ʱ������Ӧ��
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4��0.5H2O+6H3PO4
10CaSO4��0.5H2O+6H3PO4
�ٸ÷�Ӧ���ֳ����Թ�ϵ��H3PO4__________H2SO4���>����<������
�ڽ��Ԫ�������ɽ��͢��н��ۣ�P��S���Ӳ�����ͬ��__________��
��3�����ʱ��������Ca5(PO4)3F������ת��ΪHF������һ��ת��ΪSiF4��ȥ��д������HF�Ļ�ѧ����ʽ��__________��
��4��H2O2���������е��л�̼����ΪCO2�ѳ���ͬʱ����Ҳ�ᷢ���ֽ⡣��ͬͶ�ϱȡ���ͬ��Ӧʱ�䣬��ͬ�¶��µ��л�̼�ѳ�����ͼ��ʾ��80����ѳ��ʱ仯��ԭ��____________________��

��5������ʱ��CaCO3�Թ�������ַ�Ӧ������SO42������ԭ����__________������BaCO3�ɽ�һ���������ѳ��ʣ������ӷ���ʽ��____________________��
��6��ȡa g���þ������ᣬ������ˮϡ�ͣ��������̪��ָʾ������b mol��L1NaOH��Һ�ζ����յ�ʱ����Na2HPO4������NaOH��Һc mL������������H3PO4������������________������֪��H3PO4Ħ������Ϊ98 g��mol1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2A(s)![]() B(g)+C(g)������̶����ܱ������У���ʼʱ����һ������A���жϷ�Ӧ�ﵽƽ��״̬�ı�־�ǣ� �ٵ�λʱ��������2molA��ͬʱ����1molB ��v(B):v(C)=1:1 ���ܱ������л�������ƽ��Ħ���������� �ܻ��������ܶȲ��ٸı� ��B������������ٸı� ��������ѹǿ���ٸı��״̬
B(g)+C(g)������̶����ܱ������У���ʼʱ����һ������A���жϷ�Ӧ�ﵽƽ��״̬�ı�־�ǣ� �ٵ�λʱ��������2molA��ͬʱ����1molB ��v(B):v(C)=1:1 ���ܱ������л�������ƽ��Ħ���������� �ܻ��������ܶȲ��ٸı� ��B������������ٸı� ��������ѹǿ���ٸı��״̬
A. �٢ۢܢݢ� B. �٢ۢܢ� C. �٢ܢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ����գ�
��1����Է�������Ϊ72�ҷе���͵������Ľṹ��ʽΪ___
��2��д���л���ļ���ʽ��![]() ___
___
��3������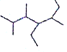 ������___
������___
��4��д��������ʽ��___����Ȳ�Ľṹʽ___
��5��ij�л��߷��ӻ�����ĽṹƬ�����£�
![]()
��ϳ����ĵ����ǣ�д�ṹ��ʽ��___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ȷ����![]()
A.N��P��As�ĵ縺����ԭ�����������������
B.�۵����Ų�Ϊ![]() ��Ԫ��λ�ڵ������ڵڢ�A�壬��p��Ԫ��
��Ԫ��λ�ڵ������ڵڢ�A�壬��p��Ԫ��
C.2p��3p�����״��Ϊ�����Σ�����Ҳ���
D.þԭ����![]() ʱ��ԭ���ͷ��������ɻ�̬ת���ɼ���̬
ʱ��ԭ���ͷ��������ɻ�̬ת���ɼ���̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ĵ���ƽ�ⳣ�������

(1)�ϱ���6������бȽϣ������������ǣ�_____��HCOO-��S2-��HSO3-���������У����ѽ��H+����__________��
(2)��Ũ�Ⱦ�Ϊ0.1mol/L��HCOOH��H2C2O4�����Һ�У�����0.1mol/L��NaOH��Һ����OH-�Ⱥ����ĵ��ἰ��ʽ��������ǣ�_________��
(3)��֪HNO2����ǿ�����ԣ�����ԭ�ԡ���HNO2��Һ�μӵ�H2S��Һ�У�ͬʱ�г�������ɫ�������ɣ�������������������Ϊ����ɫ����д������֮��Ļ�ѧ��Ӧ����ʽ��___��
(4)�������ӷ���ʽ��д��ȷ����________��
A.HNO2+HS-=NO2-+H2S��
B.2HCOOH+SO32-=2HCOO-+H2O+SO2��
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)��������SO2ͨ��Na2C2O4��Һ��д�����ӷ���ʽ___��
(6)��֪HXΪһԪ���ᡣHX�ĵ��볣��Ϊ5.5��10��8��ij�����Һ�к���4molNaX��2molNa2CO3��1molNaHCO3������Һ��ͨ��3molCO2���壬��ַ�Ӧ������ȫ�������գ�����ijЩ���ʵ�����Na2CO3______��NaHCO3______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.![]() ��
��![]() ����ˮ���ܵ��磬��KC
����ˮ���ܵ��磬��KC![]() ��
��![]() �����
�����
B.![]() ʱ��
ʱ��![]() �������
�������![]() ��NaOH��Һ�������Ϻ���ҺΪ����
��NaOH��Һ�������Ϻ���ҺΪ����
C.![]() �Ĵ�����Һ��ˮϡ��ʮ������Һ
�Ĵ�����Һ��ˮϡ��ʮ������Һ![]()
D.![]() ʱ����Ũ�Ⱦ�Ϊ
ʱ����Ũ�Ⱦ�Ϊ![]() �Ĵ����������Һ�ζ���Ũ��NaOH��Һ������pHͻ�䷶Χ��ͬ
�Ĵ����������Һ�ζ���Ũ��NaOH��Һ������pHͻ�䷶Χ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ�о�����Ҫ���⡣
��1����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��______________________��
��2�����ݻ�Ϊ2L���ܱ������У�����2mol CO2��6mol H2�����¶�500��ʱ������Ӧ��
CO2��g��+ 3H2��g��![]() CH3OH��g��+ H2O��g�� ��H<0��
CH3OH��g��+ H2O��g�� ��H<0��
CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺

���ӷ�Ӧ��ʼ��20����ʱ��H2��ƽ����Ӧ����v(H2)��_________________
����30���ӵ�35���Ӵﵽ�µ�ƽ�⣬�ı������������__________________________
A������ѹǿ B��������� C�������¶� D������Ӧ���Ũ��
����ʽ����÷�Ӧ��35���Ӵﵽ��ƽ��ʱ��ƽ�ⳣ��(����2λС��)_______________
�������30����ʱ,���������г���2mol CO2��6mol H2�������¶Ȳ��䣬�ﵽ��ƽ��ʱ��CH3OH��Ũ��____________1mol.L-1(����>������<������=��)��
��3��һ��ԭ��صĹ���ԭ��Ϊ��2Na2S2 + NaBr3![]() Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
���õ�ظ����ĵ缫��ӦʽΪ��______________________________________
�������в���CH4һ���ĵ缫��ӦʽΪ��_______________________________________��
��4����ͼ��NaOH����CO2��ij�ֲ����ˮ��Һ��pH��0��14�ķ�Χ��H2CO3��HCO3����CO32�����ֳɷ�ƽ��ʱ����ɷ�����
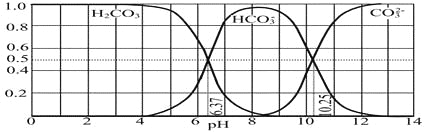
����������ȷ����_______________
A����ͼ��1.0 mol��L-1̼������Һ�ζ�1.0 mol��L-1 HCl��Һ�ĵζ�����
B����pH�ֱ�Ϊ6.37��10.25ʱ����Һ��c(H2CO3)=c(HCO3��)=c(CO32��)
C������ѪҺ��pHԼΪ7.4����CO2��ѪҺ�ж���HCO3����ʽ����
D������CO2��NaOH��Ӧ��ȡNaHCO3���˿�����Һ��pHΪ7��9֮��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com