
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
【答案】H2S HSO3﹣ H2C2O4、HCOOH、HC2O4﹣ 2HNO2+H2S=2H2O+2NO↑+S↓ DE SO2+H2O+C2O42-=HC2O4-+HSO3﹣ 0mol 6mol
【解析】
(1)相同温度下,酸的电离平衡常数越小,其酸性越弱,弱酸的酸性越强,其酸根离子水解程度越小,则结合氢离子能力越弱;
(2)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数大小判断;
(3)HNO2和H2S发生氧化还原反应,生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,据此书写方程式;
(4)强酸能和弱酸的盐反应生成弱酸和强酸盐;
(5)将少量的SO2通入Na2C2O4溶液,酸性H2C2O4>H2SO3>HC2O4->HSO3-,据此写出离子方程式;
(6)已知HX为一元弱酸,某混合溶液中含有4mol NaX、2mol Na2CO3和1molNaHCO3,NaX、NaHCO3能共存,说明HX的酸性强于碳酸氢根离子,往溶液中通入3mol
CO2气体,充分反应后,气体全部被吸收,说明HX的酸性弱于碳酸,即溶液中除了发生Na2CO3+CO2+H2O=2NaHCO3,还发生反应NaX+CO2+H2O=HX+NaHCO3,根据反应方程式进行计算。
(1)相同温度下,酸的电离平衡常数越小,其酸性越弱,弱酸的酸性越强,其酸根离子水解程度越小,则结合氢离子能力越弱,根据电离平衡常数知,酸性最弱的是H2S,酸性最强的是H2SO3,所以结合氢离子能力最弱的是HSO3-;
(2)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数知,被OH﹣先后消耗的酸及酸式酸根依次是H2C2O4、HCOOH、HC2O4-;
(3)HNO2和H2S生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,该反应方程式为2HNO2+H2S=2H2O+2NO↑+S↓;
(4)A.HNO2具有强氧化性,HS-具有还原性,二者能发生氧化还原反应,根据电子守恒、电荷守恒、离子守恒,可得反应的离子方程式为H++2HNO2+HS-=2NO↑+S↓+2H2O,A错误;
B.酸性:H2SO3>HCOOH>HSO3-,所以HCOOH和SO32-反应生成HCOO-和HSO3-,反应的离子方程式为HCOOH+SO32-=HCOO-+HSO3-,B错误;
C.酸性:H2SO3>HCOOH>HSO3-,所以H2SO3和HCOO-反应生成HCOOH、HSO3-,反应的离子方程式为H2SO3+HCOO-=HCOOH+HSO3-,C错误;
D.亚硫酸和亚硫酸根离子反应生成亚硫酸氢根离子,离子方程式为H2SO3+SO32-=2HSO3-,D正确;
E.根据电离平衡常数可知,H2C2O4的一级电离平衡常数大于HNO2,二级电离平衡常数小于HNO2,所以H2C2O4+NO2-=HC2O4-+HNO2,E正确;
故合理选项是DE;
(5)将少量的SO2通入Na2C2O4溶液,酸性H2C2O4>H2SO3>HC2O4->HSO3-,据此离子方程式为:SO2+H2O+C2O42-=HC2O4-+HSO3-;
(6)已知HX为一元弱酸,某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3,NaX、NaHCO3能共存,说明HX的酸性强于HCO3-,往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,说明HX的酸性弱于H2CO3,溶液中发生的反应有:Na2CO3+CO2+H2O=2NaHCO3,根据该反应可知2molNa2CO3能生成4molNaHCO3同时消耗二氧碳2molCO2,还有1molCO2发生反应NaX+CO2+H2O=HX+NaHCO3,生成1molNaHCO3,所以溶液中没有Na2CO3,Na2CO3的物质的量是0,NaHCO3的物质的量为1mol+4mol+1mol=6mol。


科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:
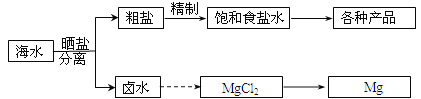
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是________________。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为______,制取它的化学方程式为__________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl26H2O;
d.将MgCl26H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为______________。
②步骤d中的“一定条件”指的是___________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?__________(填“同意”或“不同意”),请说出你同意或不同意的理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol;
C(s)+O2(g)=CO(g) △H=-110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式_________。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=-91kJ/mol
CH3OH(g) △H=-91kJ/mol
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是________
A.2molCO和4molH2 B.2molCO、1molCH3OH和4molH2
C.4molCO和4molH2 D.4molCO和6molH2
②将1molCO和2molH2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,若在相同条件下,起始时在该容器中充入CH3OH(g),反应达到平衡时的热量变化是______(填“吸收”或“放出”)_______kJ热量。
Ⅱ.在1.0L恒容密闭容器中放入0.10molA(g),在一定温度进行如下反应。
A(g)![]() 2B(g)+C(g)+D(s) △H=+85.5kJ/mol
2B(g)+C(g)+D(s) △H=+85.5kJ/mol
容器内气体总压强(p)与起始压强p0的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。

回答下列问题:
(3)下列能提高A的转化率的是___。
A.升高温度 B.向体系中通入A气体
C.减少D的物质的量 D.向体系中通入稀有气体He
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围_________。
(5)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时B的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积约为1×10-12,将VaL pH=2的硫酸溶液与VbL pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为 ( )
A. 2∶11B. 2∶9C. 11∶2D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A 气体和2mol B 气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g) B(g) 2C(g) 。若经 2s 后测得C 的浓度为 0.6mol·L-1,现有下列几种说法:
①用物质A 表示的反应平均速率为 0.3mol·L-1·s-1
②用物质B 表示的反应的平均速率为 0.6mol·L-1·s-1
③2s 时物质A 的转化率为 70%
④2s 时物质B 的浓度为 0.7mol·L-1
其中正确的是( )
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,0.1 mol/L某酸HA溶液的pH=3。关于该溶液叙述正确的是
A. 溶质的电离方程式为HA→H+ + A- B. 升高温度,溶液的pH增大
C. 若加入少量NaA固体,则c(A-)降低 D. 该溶液稀释10倍后,pH < 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com