
【题目】降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。
CH3OH(g)+ H2O(g) △H<0。
CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________
②从30分钟到35分钟达到新的平衡,改变的条件可能是__________________________
A.增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)_______________
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3![]() Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为:______________________________________
②电解池中产生CH4一极的电极反应式为:_______________________________________。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
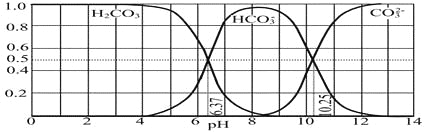
下列叙述正确的是_______________
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
【答案】CH3OH(l)+ O2(g) =CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol 0.075mol/( L·min) D 0.15 mol-2.L2 > 2S22- - 2e-=S42- CO2+8e-+6H2O=CH4+8OH- C D
【解析】
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(2)①10min时甲醇的浓度为0.50mol/L,根据化学计量数计算出氢气的浓度变化,再计算出氢气的平均反应速率;
②平衡正向移动了,从影响平衡移动的因素考虑;
③用三段式法求算,代入K的计算公式计算即可,K=![]() ;
;
④从浓度和平衡移动的角度分析;
(3)①电池负极发生氧化反应,化合价升高的物质在负极反应,据此分析;
②CO2转化为甲烷,C的价态有+4价变为-4价,发生还原反应,再注意电解质溶液即可写出电极方程式;
(4)A、由图象可以看出,开始H2CO3浓度最大,CO32-浓度最小,不可能根据1.0 molL-1HCl溶液滴定1.0 molL-1碳酸钠溶液的实验数据绘出;
B、由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-);
C、由图可知,pH为7.4时,HCO3-的最大;
D、在PH为7~9时,溶液中多以HCO3-形式存在。
(1)根据盖斯定律:(①-②+③×4)×0.5整理可得CH3OH(l)+ O2(g)=CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol ;
(2)①从反应开始到20分钟时,CH3OH的平均反应速率v(CH3OH)= ![]() =0.025mol/(L·min),根据方程式可得:v(H2):v(CH3OH)=3:1.所以v(H2)=0.075mol/(L·min);
=0.025mol/(L·min),根据方程式可得:v(H2):v(CH3OH)=3:1.所以v(H2)=0.075mol/(L·min);
②从30分钟到35分钟达到新的平衡,c(CH3OH)增大,
A. 从30分钟到35分钟时,若增大压强,需要缩小容器体积,甲醇浓度变化不会逐渐变化,应该立即变化,错误;
B.加入催化剂,使化学反应速率正反应与逆反应改变的倍数相同,因此平衡不发生移动,物质的浓度也不变;
C.升高温度,平衡逆向移动,c(CH3OH)会减小,错误;
D.增大反应物的浓度,平衡正向移动,产生更多的甲醇,使其浓度增大,正确;
故答案选D。
③ CO2(g)+3H2(g)CH3OH(g)+H2O(g)(各物质浓度mol/L)
反应前 1 3 0 0
反应了 0.70 0.21 0.70 0.70
平衡后 0.30 0.79 0.70 0.70
K= ![]() =
=![]() =0.15mol-2L2;
=0.15mol-2L2;
故答案为:0.15 mol-2.L2;
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,若平衡不发生移动,则CH3OH的浓度应该是1mol/L。但是增大浓度的同时,容器的压强也增大,增大压强,平衡向气体体积减小的方向即向正反应方向移动,因此CH3OH的浓度大于1mol/L;
(3)①根据电池总反应式可知该电池负极是Na2S2。该电极的反应式是2S22- - 2e-=S42- ;
②由于是使CO2在铜电极上可转化为甲烷,C原子得到电子。所以在电解池中产生CH4一极(即阴极)的电极反应式为:CO2+8e-+6H2O=CH4+8OH-;
(4)A.该图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,错误;
B.有分布示意图可知:在pH为6.37溶液中c(H2CO3)=c(HCO3-);在pH=10.25时,溶液中c(HCO3-)=c(CO32-
C.人体血液的pH约为7.4,则根据微粒的存在与溶液的pH关系可知:CO2在血液中多以HCO3-形式存在,正确;
D.由于在溶液的pH为7~9之间时含C微粒主要以HCO3-存在,所以若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间,正确;
故答案选CD。


科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:
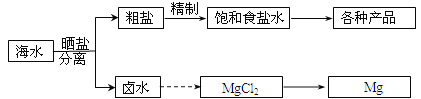
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是________________。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为______,制取它的化学方程式为__________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl26H2O;
d.将MgCl26H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为______________。
②步骤d中的“一定条件”指的是___________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?__________(填“同意”或“不同意”),请说出你同意或不同意的理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,0.1 mol/L某酸HA溶液的pH=3。关于该溶液叙述正确的是
A. 溶质的电离方程式为HA→H+ + A- B. 升高温度,溶液的pH增大
C. 若加入少量NaA固体,则c(A-)降低 D. 该溶液稀释10倍后,pH < 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向K2S溶液中加水稀释![]() 会减小
会减小
B.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
C.取c(H+)=0.01mol·L-1的盐酸和醋酸各1L,分别加入0.3g锌粉,在相同条件下充分反应,盐酸与锌反应的平均速率大
D.向CuS和FeS均饱和的混合溶液中加入少量Na2S固体,![]() 保持不变
保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识与技能考查
(1)Na2S2O3与稀硫酸反应(化学方程式):___;
(2)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,写出相关离子方程式:___;
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是___。(填写化学式,只填一种即可)
(4)碳酸氢钠溶液中:比较c(H2CO3)___c(CO32-)(答>,<,=)
(5)常温下,将0.1mol/L盐酸和0.1mol/L的NaOH按体积比11:9混合后,溶液的pH为___;
(6)写出碳酸钠溶液的物料守恒___;在2mol/L的氨水中,加入等体积1mol/L的盐酸,写出质子守恒(水的电离守恒):___;
(7)如图是甲烷燃料电池原理示意图,回答下列问题:电池的负极是___(填“a”或“b”)极,该极的电极反应式是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数分别为Kal(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.H2SO4在冰醋酸中的电离方程式为H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B.H2SO4在冰醋酸中:![]() =c(HSO4-)+2c(SO42-)+c(CH3COO-)
=c(HSO4-)+2c(SO42-)+c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸, 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均是由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。下列说法错误的是
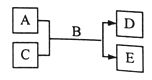
A.简单离子半径大小关系:Y>Z>X>WB.图示反应中有离子键的形成
C.简单阴离子的还原性:Y>ZD.D的水溶液中含有阴、阳离子及共价键形成的分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com