
分析 ①碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;
该反应中KI是还原剂,还原剂对应的产物是氧化产物,KIO3是氧化剂,氧化剂对应的产物是还原产物,所以氧化产物、还原产物都是碘,物质的量之比为 5:1;该反应中有碘单质生成,碘遇淀粉变蓝色,所以观察到溶液变蓝色;
②根据反应方程式找出关系式IO3-~3I2~6S2O32-,再利用滴定数据计算出碘酸钾的质量,最后计算出1Kg食用盐中含有的碘酸钾质量,根据计算结果判定该盐是否合格;硫代硫酸钠属于强碱弱酸盐,溶液显示碱性.
解答 解:①碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;该反应中KI是还原剂,还原剂对应的产物是氧化产物,KIO3是氧化剂,氧化剂对应的产物是还原产物,所以氧化产物、还原产物都是碘,物质的量之比为 5:1;
该反应中有碘单质生成,碘遇淀粉变蓝色,所以观察到溶液变蓝色,
故答案为:5:1; 溶液变蓝色;
②根据反应IO3-+5I-+6H+=3I2+3H2O,以及I2+2S2O32-(无色)→2I-+S4O62-(无色),得出反应的关系式IO3-~3I2~6S2O32-,
又n(Na2S2O3)=0.030mol/L×0.018L=0.00054mol,
则IO3-~3I2~6S2O32-
1 6
n(IO3-) 0.00054mol
解得:n(IO3-)=$\frac{1}{6}$×0.00054mol=0.00009mol,m(KIO3)=0.00009mol×214g/mol=0.01926g=1.926mg,
所以1kg食盐中:m(KIO3)=$\frac{1000}{428}×1.926mg$=45mg,在40~50mg 之间,
所以该食盐合格,
故答案为:45mg;是合格产品.
点评 本题考查较为综合,氧化还原反应和离子反应的计算 及物质含量的测定,题目难度中等,解答时注意把握反应的关系式.


科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
NA代表阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA
B.含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间
C.5NH4NO3 4N2↑+2HNO3 +9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
4N2↑+2HNO3 +9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
D.在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
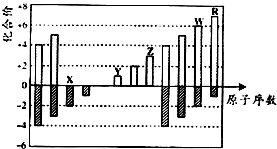
| A. | 原子半径:Z<Y<X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
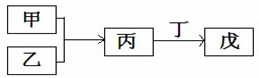 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为:甲<丙<戊 | |
| B. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2 | |
| C. | 若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s23p8 | B. | 3d10 | C. | 3s23p64s2 | D. | 3s23p63d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层有3个电子的一种金属 | |
| B. | 熔点低于100℃的一种金属 | |
| C. | 次外电子层上有8个电子的一种元素 | |
| D. | 除最外层,原子的其他电子层电子数目均达饱和的一种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者反应的平均速率相等 | B. | 二者溶质的物质的量浓度不相等 | ||
| C. | 二者生成二氧化碳的体积相等 | D. | 二者中氢离子的浓度不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com