
【题目】下列有关实验的说法正确的是( )
A.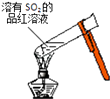 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B.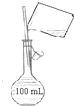 配制100 mL 0.10 molL﹣1NaCl溶液
配制100 mL 0.10 molL﹣1NaCl溶液
C.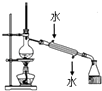 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D.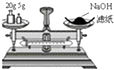 称量25 g NaOH
称量25 g NaOH
【答案】B
【解析】解:A.二氧化硫的漂白性不稳定,加热时易复原,所以加热二氧化硫漂白后的溶液时,溶液由无色变为红色,故A错误;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流,否则易溅出溶液导致配制溶液浓度偏低,故B正确;
C.用蒸馏法制取蒸馏水时,如果馏分急剧冷却会炸裂冷凝管,为防止炸裂冷凝管,所以冷凝管中上口为进水口、下口为出水口,故C错误;
D.用托盘天平称量药品时遵循“左物右砝”原则,且腐蚀性药品要放置在烧杯中称量,NaOH具有强腐蚀性,为防止腐蚀托盘天平,称量氢氧化钠固体时放置在烧杯中,故D错误;
故选B.
A.二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,受热易复原;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流;
C.蒸馏时,温度计测量馏分温度,冷凝管中水应该采用“下进上出”原则;
D.用托盘天平称量药品时应该采取“左物右砝”原则,且具有腐蚀性药品应该放置在烧杯中称量.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.O2和O3互为同位素
B.金刚石、石墨、富勒烯互为同素异形体
C.有机物CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体
D.C4H10的一氯代物有四种,其熔沸点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的酸性溶液中,能共存的离子组是( )
A.NH4+、Cl﹣、Fe2+、K+B.Na+、CO32﹣、K+、Cl﹣
C.Cl﹣、Ba2+、Na+、SO42﹣D.K+、SO42﹣、OH﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 。
(3)A的氢化物属于 (填“极性”或“非极性”)分子,D的低价氧化物分子的立体构型是 。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为 (每个球均表示1个原子)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B. 配制100 mL 0.10 molL﹣1NaCl溶液
配制100 mL 0.10 molL﹣1NaCl溶液
C. 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D. 称量25 g NaOH
称量25 g NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 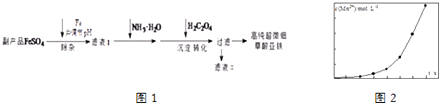
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4水溶液中H2C2O4、HC2O4﹣和C2O42﹣三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( ) 
A.曲线①代表的粒子是HC2O4﹣
B.0.1molL﹣1NaHC2O4溶液中:c(C2O42﹣)>c(H2C2O4)
C.pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42﹣)>c(H2C2O4)>c(HC2O4﹣)
D.在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42﹣)将减小,c(Ca2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱去冶金工业排放烟气中SO2的方法有多种.
(1)利用本生(Bunsen)热化学循环吸收SO2工艺由下列三个反应组成: 2H2(g)+O2(g)═2H2O(I)△H1=﹣572kJmol﹣1
2HI(g)═H2(g)+I2(g)△H2=+10kJmol﹣1
2H2SO4(I)═2SO2(g)+2H2O(g)+O2(g)△H3=+462kJmol﹣1
则得SO2(g)+I2(g)+2H2O(I)═2HI (g)+H2SO4(I)△H=kJmol﹣1
(2)氧化锌吸收法.配制ZnO悬浊液,在吸收塔中封闭循环脱硫.测得pH、吸收效率η随时间t的变化如图1所示;溶液中部分微粒与PH的关系如图2所示. 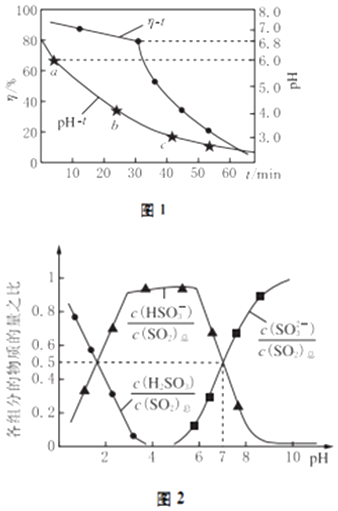
①为提高SO2的吸收效率η,可采取的措施有:增大悬浊液中ZnO的量、 .
②图1中的pH﹣t曲线ab段发生的主要化学方程式为
③pH=7时,溶液中 ![]() =
=
(3)如图3所示,利用惰性电解电解含SO2的烟气回收S及H2SO4 , 以实现废物利用. 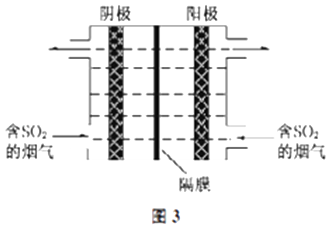
①阴极的电极反应式为 .
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量分别为、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行过滤操作应选用的一组仪器是
A. 烧杯、酒精灯、试管、铁架台(铁圈)、漏斗
B. 滤纸、烧杯、试管夹、漏斗、玻璃棒
C. 烧杯、漏斗、玻璃棒、铁架台(铁圈)、滤纸
D. 滤纸、试管、漏斗、铁架台(铁圈)、玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com