
【题目】(10分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

I.已知该产业链中某反应的平衡表达式为:![]() ,它所对应反应的化学方程式___________________(要注明物质的状态).
,它所对应反应的化学方程式___________________(要注明物质的状态).
II、二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0MPa,温度230~280 ℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g) △H1=一90.7kJ·mol-1
CH3OH(g) △H1=一90.7kJ·mol-1
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2=一23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=一23.5 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
(1)催化反应室中总反应的热化学方程式为______________。830℃时反应③的K=1.0 ,则在催化反应室中反应③的K___1.0 (填“> ”、“< ”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为,c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50% ,则5 min 内CO的平均反应速率为______;若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=amol/L,达到平衡后,c(CH3OH)=2mol/L,a=______mol/L。
【答案】(10分,每题2分)I.C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
(1)2CO(g)+4H2(g)![]() CH3OCH3(g)+ H2O(g) △H=-204.9kJ/mol >
CH3OCH3(g)+ H2O(g) △H=-204.9kJ/mol >
(2)0.1mol/(L·min) 5.4
【解析】
试题分析:I.化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据某反应的平衡表达式![]() 可知该反应的化学方程式为C(s)+H2O(g)
可知该反应的化学方程式为C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
II、(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=一90.7kJ·mol-1
CH3OH(g) △H1=一90.7kJ·mol-1
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2=一23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=一23.5 kJ·mol-1
则根据盖斯定律可知①×2+②即得到催化反应室中总反应的热化学方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+ H2O(g) △H=-204.9kJ/mol。
CH3OCH3(g)+ H2O(g) △H=-204.9kJ/mol。
催化反应室中温度小于830℃,升高温度反应③平衡向正反应移动,平衡常数增大。
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)=0.5mol/L÷5min=0.1mol/(Lmin);该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数![]() ,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以
,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以![]() ,解得y=1.4,故a=2mol/L×2+1.4mol/L=
,解得y=1.4,故a=2mol/L×2+1.4mol/L=


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体总质量
⑧混合气体总体积
A.①②③④⑤⑥⑦⑧ B.①⑤⑧
C.②⑤⑦ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1mol,5min后温度升高到830℃,此时测得C为0.4mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式:![]() =
=![]() ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知8838Sr位于IIA族,下列有关Sr的说法不正确的是
A. 8838Sr的中子数为38 B. 最高化合价为+2
C. 原子半径:Sr > Ca D. 氢氧化物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体数目的叙述不正确的是( )
A. 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C. 含有5个碳原子的某饱和链烃,其一氯代物有3种
D. 菲的结构为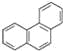 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 食用植物油属于人体所需的三大营养物质之一
B. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
C. 淀粉、蛋白质、葡萄糖都是高分子化合物
D. 甲烷、汽油、生物柴油、酒精都是碳氢化合物,均可作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是 。
Ⅱ.牙膏样品中碳酸钙的定量测定:
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有: 。
(4)C中反应生成BaCO3的化学方程式是 。
(5)下列各项措施中,不能提高测定准确度的是 (填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g,则样品中碳酸钙的质量分数为 。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com