
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( ) 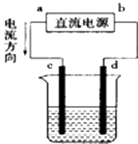
A.a为负极,b为正极
B.d为阳极,c为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】两种不同的烃CxHy和CaHb不论以什么比例混合,只要总质量一定,完全燃烧时消耗O2的质量和生成水的质量不变,下列叙述正确的是( )
A.CxHy和CaHb分子中氢原子系数一定相等
B.可能是C2H4和C3H6的混合物
C.CxHy和CaHb一定是同分异构体
D.CxHy和CaHb的最简式可以不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2是人体呼吸中不可缺少的气体.Y是地壳中含量最多的金属元素,Z元素的焰色为黄色,W2是一种黄绿色气体.请回答下列问题:
(1)写出Z元素符号 , 画出X的原子结构示意图;
(2)工业上利用W2和消石灰制取漂白粉,则漂白粉的有效成分是;
(3)Z元素组成的两种盐A、B在一定条件下可以互相转化,A、B都可与足量盐酸反应且产物完全一样,其中A是发酵粉的主要成分之一,则B通过化合反应转化为A的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL 0.1molL﹣1CH3COONa溶液中,不断通入HCl后,CH3COO﹣与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( ) 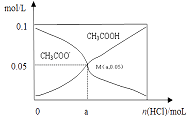
A.M点溶液中水的电离程度比原溶液小
B.在M点时,c(H+)﹣c(OH﹣)=(100a﹣5.0×10﹣2) mol/L
C.随着HCl的通入, ![]() 值不断减小
值不断减小
D.当n(HCl)=1.0×10﹣3mol时,溶液中c(Na+)>c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(gmol﹣1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 3.48 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 1.58 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是 .
A.蔗糖
B.硫酸钾
C.高锰酸钾
D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 .
(3)配制上述“鲜花保鲜剂”用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 , (填写所缺仪器的名称).
(4)配制溶液时有以下几个操作:①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是(填序号).
(5)若定容时俯视容量瓶刻度线,会使所配溶液浓度(填偏大、偏小、不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z均为原子序数依次增大的短周期主族元素,W,X,Y处于同一周期,W元素形成的化合物种类最多,W和Y族序数之和为X族序数的2倍,Z的最高价氧化物对应的水化物既能溶于酸又能溶于碱,下列说法中正确的是( )
A.简单气态氢化物沸点Y>X>W
B.原子半径Z>Y>X>W
C.Y元素可能位于第二周期第ⅦA族
D.Y元素与其它三种元素均可形成多种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清溶液,其中可能含有Na+、Mg2+、Ba2+、Cl﹣、SO ![]() 、CO
、CO ![]() 离子.现进行以下实验: ①用pH试纸检验溶液,发现溶液呈强酸性;
离子.现进行以下实验: ①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变成碱性,无沉淀产生;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生.
(1)根据上述事实确定:该溶液中肯定存在的离子有;肯定不存在的离子有;可能存在的离子有 .
(2)写出③中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气体(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)写出有关反应的方程式,是离子反应的写离子方程式:;;;
(2)2.24L气体的成分为:;
(3)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:第一种情况:n(Na2O2)=mol和n(NaHCO3)=mol;
第二种情况:n(Na2O2)=mol和n(NaHCO3)=mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com