
【题目】研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g) △H=-198kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) △H=-41.8kJ·mol-1
若CO的燃烧热为283 kJ·mol-1,则1molNO2和1mol CO 反应生成CO2和NO的能量变化示意图中E2= _________kJ·mol-1

(2)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
②第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,在10分钟时达到平衡,CO的物质的量变化了1mol。请在图B中画出SO2浓度从6~11分钟的变化曲线。

(3)己知某温度下,H2SO3的电离常数为K1≈l.5×10-2, K2≈1.0×10-7,用NaOH溶液吸收SO2,当溶液中HSO3-, SO32-离子相等时,溶液的pH值约为_________
(4)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为_________,连二亚硫酸根与HNO2反应的离子方程式_________。
【答案】 359.8kJ·mol-1 正反应放热,温度升高平衡逆向移动,SO2平衡转化率降低。温度高于445℃后硫变成气态,正反应吸热,温度升高平衡正向移动, SO2平衡转化率增加。 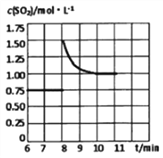 7 2HSO3-+2e-+2H+=S2O42-+2H2O 3S2O42-+2HNO2+2H2O =6HSO3-+N2 ↑
7 2HSO3-+2e-+2H+=S2O42-+2H2O 3S2O42-+2HNO2+2H2O =6HSO3-+N2 ↑
【解析】(1)已知:① 2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ·mol-1,②SO2(g)+NO2(g)=SO3(g)+NO(g) △H2=-41.8kJ·mol-1,③CO(g) +![]() O2(g) =CO2(g) △H3=-213kJ·mol-1,根据盖斯定律可知,由②+③-①×
O2(g) =CO2(g) △H3=-213kJ·mol-1,根据盖斯定律可知,由②+③-①×![]() 可得NO2(g) +CO(g) =CO2(g) +NO(g) ,即△H= (-41.8kJ·mol-1)+(-213kJ·mol-1)-(-198kJ·mol-1)×
可得NO2(g) +CO(g) =CO2(g) +NO(g) ,即△H= (-41.8kJ·mol-1)+(-213kJ·mol-1)-(-198kJ·mol-1)×![]() =-155.8kJ·mol-1,则E2=E1-△H=(134kJ·mol-1)-(-225.8kJ·mol-1)=359.8kJ·mol-1 ;
=-155.8kJ·mol-1,则E2=E1-△H=(134kJ·mol-1)-(-225.8kJ·mol-1)=359.8kJ·mol-1 ;
(2)①由图示可知SO2的平衡转化率随反应温度的变化是先降低,但当温度达到后445℃,再升温,转化率反应而升高,出现此现象的可能原因是:正反应放热,温度升高平衡逆向移动,SO2平衡转化率降低。温度高于445℃后硫变成气态,正反应吸热,温度升高平衡正向移动, SO2平衡转化率增加;
②某温度下在2L恒容密闭容器中发生2CO(g)+SO2(g)![]() S(l)+2CO2(g),通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2,此时SO2的物质的量为1.5mol,浓度为0.75mol/L;第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,此时SO2的浓度为1.5mol/L,此时平衡会正向进行,10分钟时达到平衡,CO的物质的量变化了1mol。SO2变化0.5mol,重新平衡时SO2的浓度为
S(l)+2CO2(g),通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2,此时SO2的物质的量为1.5mol,浓度为0.75mol/L;第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,此时SO2的浓度为1.5mol/L,此时平衡会正向进行,10分钟时达到平衡,CO的物质的量变化了1mol。SO2变化0.5mol,重新平衡时SO2的浓度为![]() =1mol/L,可得SO2浓度从6~11分钟的变化曲线为
=1mol/L,可得SO2浓度从6~11分钟的变化曲线为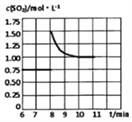 ;
;
(3)根据HSO3-![]() SO32-+H+平衡常数K=
SO32-+H+平衡常数K=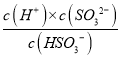 =1.0×10-7,此时HSO3-, SO32-离子相等,则c(H+)=1.0×10-7mol/L,溶液的pH=7;
=1.0×10-7,此时HSO3-, SO32-离子相等,则c(H+)=1.0×10-7mol/L,溶液的pH=7;
(4)亚硫酸氢钠电解产生连二亚硫酸根发生还原反应,应在电解池的阴极进行,电极反应为2HSO3-+2e-+2H+=S2O42-+2H2O;连二亚硫酸根与HNO2反应生成无毒气体为氮气,则HNO2发生还原反应,连二亚硫酸根发生氧化反应生成HSO3-,则发生反应的离子方程式为3S2O42-+2HNO2+2H2O =6HSO3-+N2↑。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是
A. 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B. 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C. 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D. 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤、石油、沼气属于人类利用的主要化石燃料
B.煤干馏是复杂的物理化学变化,可得到焦炭、煤焦油和焦炉煤气等
C.氢气是一种清洁能源
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.溴化银是一种重要的感光材料,是胶卷中的核心成分之一
B.硅晶体是一种重要的半导体材料,还可用于制造光导纤维
C.镁燃烧发出耀眼的白光,常用于制造信号弹和焰火
D.硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
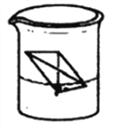
【题目】钠与水反应的改进实验操作如下:取一张滤纸,用酚酞试液浸润并晾干,裁剪并折叠成信封状,滤纸内放一小块(约绿豆粒般大小)金属钠,把含钠的滤纸信封放入水中,装置如下图所示。
请回答:
(1)写出金属钠与水反应的离子方程式________________。
(2)实验过程中取用金属钠的操作方法是________________。
(3)有关此实验的说法正确的是________________。
A.实验过程中,可能听到爆鸣声
B.实验过程中,看到滤纸信封由白色逐渐变红色
C.实验改进的优点之一是由实验现象能直接得出反应产物
D.实验过程中,多余的金属钠不能放回原试剂瓶中,以免对瓶内试剂产生污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以环氧乙烷和布洛芬为主要原料,按下列路线合成药物布洛芬酰甘氨酸钠。
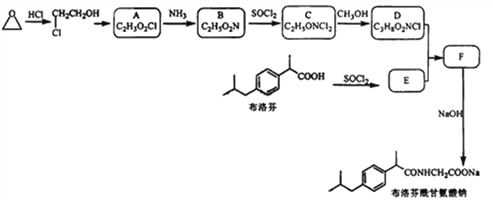
己知:(1)RCOOH ![]() RCOC1
RCOC1 ![]() RCOORˊ
RCOORˊ
(2)R-Cl- ![]() R-NH2
R-NH2 ![]() R-NH2HC1
R-NH2HC1 ![]() RCONHR
RCONHR
请回答:
(1)写出化合物的结构简式:B_________ ; D_________ 。
(2)下列说法不正确的是_________。
A.![]() 转化为A为氧化反应
转化为A为氧化反应
B. RCOOH与SOCl2反应的产物有SO2和HC1
C.化合物B能发生缩聚反应
D.布洛芬酰甘氨酸钠的分子式为C15H19NO3Na
(3)写出同时符合下列条件的布洛芬的所有同分异构体_________。
①红外光谱表明分子中含有酯基,实验发现能与NaOH溶液1∶2反应,也能发生银镜反应;
②H—NMR谱显示分子中有三个相同甲基,且苯环上只有一种化学环境的氢原子。
(4)写出F→布洛芬酰甘氨酸钠的化学方程式_________。
(5)利用题给信息,设计以![]() 为原料制备(
为原料制备(![]() )的合成路线(用流程图表示:无机试剂任选)_____________________。
)的合成路线(用流程图表示:无机试剂任选)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是重要的化工原料,以下是某酮酸E的合成路线。
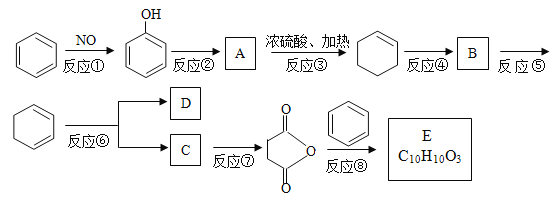
已知:
CH3CH=CHCH3能被氧化成乙酸;
②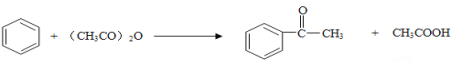
(1)以上合成路线中,属于氧化反应的有:反应⑥和反应________(填反应编号);反应⑤的反应条件是_________________________。
(2)写出结构简式A_______________________;B______________________。
(3)已知C的分子式为C4H6O4,则D的结构简式为______________________;分离C和D的方法是______________。
(4)不能由![]() 直接制取
直接制取![]() ,原因是_____________________________________。
,原因是_____________________________________。
(5)写出反应⑧的化学方程式____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com