
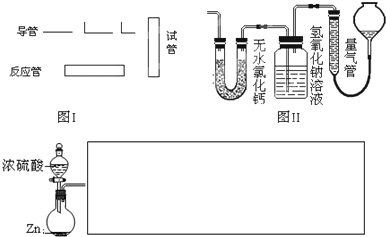
| 仪器符号 | 仪器中所加物质 | 作用 |
| 最后一种装置(作图时请对其编号) | 浓硫酸 | 防止空气中水蒸气进入E中干扰实验 |
| ||
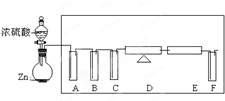 ,
, ;
;| 仪器符号 | 仪器中所加物质 | 作用 |
| A B C D E | 品红溶液 酸性KMnO4溶液 浓硫酸 氧化铜 无水硫酸铜 | 检验SO2 除去SO2 除去水蒸气 将H2氧化为H2O 检验H2O,证明有H2生成 |
| ||
| ||
| m |
| 32 |
| m |
| 32 |
| 5m |
| 8 |
| ||
| 0.05 |
| V |
| 11.2 |
| 5m |
| 8 |
| V |
| 11.2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| KW/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
| 纯水 | 加少量盐酸 | 加少量NaOH | |
| c(H+) | 1.0×10-7 mol/L | 增大 | |
| c(OH-) | 1.0×10-7 mol/L | 增大 | |
| c(H+)和c(OH-)大小比较 | c(H+)=c(OH-) | c(H+) | c(H+) |
| 水的电离平衡移动方向 | |||
| KW值 | 1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
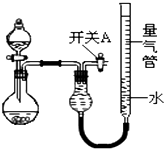 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
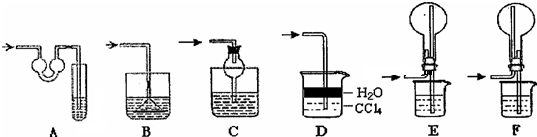
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com