


科目:高中化学 来源: 题型:
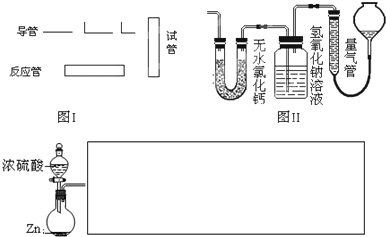
| 仪器符号 | 仪器中所加物质 | 作用 |
| 最后一种装置(作图时请对其编号) | 浓硫酸 | 防止空气中水蒸气进入E中干扰实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mo1 |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
| n(CH4) |
| n(H2O) |
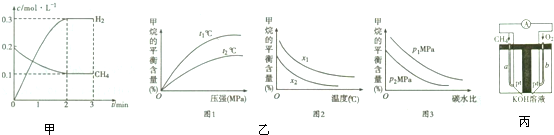
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与三氯化铁溶液反应:Fe+Fe3+═2Fe2+ |
| B、足量的氯气通入溴化亚铁溶液中:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| C、Fe与氢碘酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、Fe(OH)2与稀硝酸反应:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li是正极,MnO2是负极 |
| B、放电时负极的反应:Li-e-═Li+ |
| C、放电时正极的反应:MnO2-+e-═MnO2 |
| D、电池放电时,产生高锰酸根离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com