
【题目】把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )
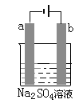
A. 逸出气体的体积a电极的小于b电极的
B. 一电极逸出无味气体,另一电极逸出刺激性气味气体
C. a电极附近呈蓝色,b电极附近出现红色
D. a电极附近呈红色,b电极附近出现蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的记录正确的是 ( )
A. ①②③ B. ①②④ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应![]() 设计成如图所示的原电池。下列判断正确的是
设计成如图所示的原电池。下列判断正确的是
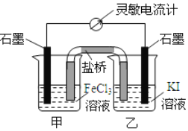
A. 反应开始时,甲中石墨电极上发生氧化反应
B. 反应开始时,乙中石墨电极上![]() 被还原
被还原
C. 电流计读数为零时,反应达到化学平衡状态,但反应还在进行
D. 电流计读数为零后,在甲中溶入![]() 固体,甲中石墨电极为正极
固体,甲中石墨电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出配平的该反应的化学方程式:_______________
②被氧化的元素是___________
(2)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+==Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①写出CuH在氯气中燃烧的化学反应方程式:___________________________________.
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________.
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组,用下列仪器、药品验证足量合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(N2和O2的用量可自由控制,气体液化温度:NO2:21℃,NO:-152℃)
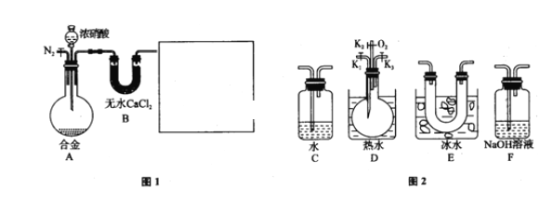
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为_________.
(2)反应前先通入N2目的是_______________________________________.
(3)确认气体中含NO的现象是_____________________________________.
(4)本题中,浓硝酸(含溶质a mol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。
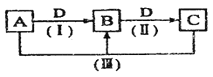
请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:__________________________________(此反应的条件答题时不必写出)。B在工业上用于制备A,反应的化学方程式为:__________________________________。
(2)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)的化学方程式______________________________________________,其中氧化产物与还原产物的物质的量之比为______________。
(3)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①D的电子式为________________。
②写出反应(Ⅲ)的离子方程式:________________________________________________。
③取100mL B、C的混合溶液,其中B、C浓度均为0.1mol/L ,向溶液中缓慢滴加0.1mol/L盐酸至过量,收集并测量产生气体的体积。刚开始滴加盐酸时,反应的离子方程式为___________________________。请将产生气体的体积(标准状况下且不考虑产生气体在水中的溶解)随滴加盐酸的体积变化的曲线绘制在下图坐标系中。__________
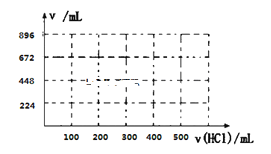
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
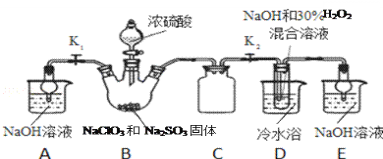
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为________________________;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________;检验该离子的方法是________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________;
实验Ⅱ:样品杂质分析与纯度测定
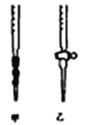
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________(填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com