
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 0.1mol·L-1 Na2SO3溶液加水稀释,c(H+)∶c(SO![]() )的值逐渐减小
)的值逐渐减小
B. pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol·L-1
C. pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性
D. 把0.2mol·L-1醋酸与0.1mol·L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+)
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】据测,哈雷彗星上碳的两种同位素12C和13C的原子个数之比为65:1,而地球上12C和13C的原子个数之比为89∶1。 地球上碳元素的相对原子质量是 12.011,那么哈雷彗星上碳元素的相对原子质量应是 ( )
A.12.000B.12.009
C.12.015D.12.005
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中Z单质的沸点最高
B.X和W的常见单质的分子式分别为X2和W2
C.W的氢化物沸点比X的氢化物的沸点低
D.R最高氧化物水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )
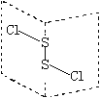
A.S2Cl2的结构中各原子均达到8电子的稳定结构
B.S2Cl2为含有极性键和非极性键的共价化合物
C.若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.试推断: 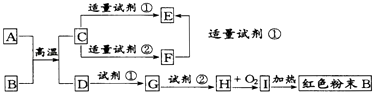
(1)写出物质的化学式:A:B:C:Ⅰ: .
(2)向F中逐滴滴加试剂①的现象为 .
(3)写出下列反应的方程式: C→E的离子方程式
C→F的离子方程式
G→H的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
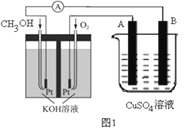
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。
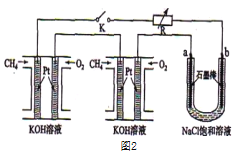
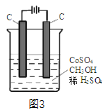
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 . 在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,
(1)氧化剂是__,氧化产物是__.
(2)写出该反应的离子方程式.__.
(3)若有219gHCl参加反应,产生Cl2的体积(标况下)为__ L,转移电子__ mol.
(4)Cl2有毒,多余的Cl2通常用氢氧化钠溶液吸收,反应的离子方程式为:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com