
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白。
(1)图中标号处需加入的相应物质分别是①、②、③、④、⑤;
(2)写出①处发生反应的离子方程式;
写出③处发生反应的化学方程式;
(3)铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:铁红;氧化铜。
【答案】
(1)①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑,2Fe3++Fe=3Fe2+ , Cu2++Fe=Cu+Fe2+ , 2Au3++3Fe=2Au+3Fe2+;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3;用作红色涂料;用作制造铜盐的原料
【解析】由工艺流程图示知,E为铁元素的离子,而A为铜、金的单质,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,因此①处加入的物质为铁屑,发生的反应为Fe+2H+=Fe2++H2↑,2Fe3++Fe=3Fe2+ , Cu2++Fe=Cu+Fe2+ , 2Au3++3Fe=2Au+3Fe2+;②处加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的氯化亚铁溶液与含Fe2+的E溶液相混合;③处利用金不溶于硝酸的性质将铜与金分离开;④处将得到的铜离子用氢氧化钠转化为氢氧化铜沉淀,从而再受热分解得到氧化铜;⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解得到铁红(氧化铁)。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 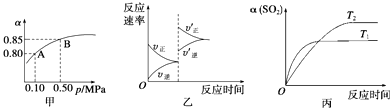
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯乙烯为原料,通过如下途径可以合成一种高分子化合物F:
(1)写出结构简式:B , F。
(2)多种试剂可以使B转化为C,写出其中任意三种的名称: , , 。
(3)实现反应④需要加入的物质是 , 反应条件为 , 反应类型为。
(4)每两分子E经过一步反应可生成一分子含有3个六元环的有机物,写出化学方程式?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
(2)若试管内液面上升,则原溶液呈性,发生腐蚀,电极反应式为:负极: , 正极:。
(3)若试管内液面下降,则原溶液呈性,发生腐蚀。电极反应式为,负极: , 正极:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的三态的熵值的大小关系正确的是( )
A.S(s)>S(l)>S(g)
B.S(l)>S(s)>S(g)
C.S(g)>S(l)>S(s)
D.S(g)>S(s)>S(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列处理事故的方法中不正确的是
A.炒菜时油锅着火,用锅盖盖灭
B.家用电器着火,用水扑灭
C.图书、档案着火,用二氧化碳灭火器扑灭
D.厨房天然气管道漏气,立即关闭阀门并轻轻开窗通风
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境. 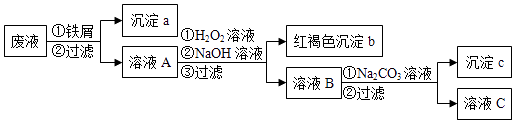
请回答:
(1)沉淀a中含有的单质是;
(2)沉淀b的化学式是;
(3)沉淀c的化学式是;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
A.是熵减反应
B.是熵增效应大于能量效应
C.是吸热反应
D.是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com