
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境. 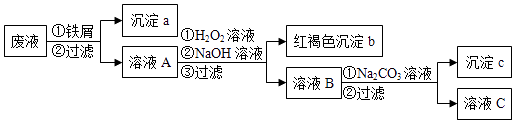
请回答:
(1)沉淀a中含有的单质是;
(2)沉淀b的化学式是;
(3)沉淀c的化学式是;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 .
科目:高中化学 来源: 题型:
【题目】钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在部分发生反应,在部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为;加入硅、锰和铝的目的是。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹(填“前”或“后”)加入,原因是。
(4)炼铁和炼钢生产中,尾气中均含有的主要污染物是。从环保和经济角度考虑,上述尾气经处理可用作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白。
(1)图中标号处需加入的相应物质分别是①、②、③、④、⑤;
(2)写出①处发生反应的离子方程式;
写出③处发生反应的化学方程式;
(3)铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:铁红;氧化铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是( )
A. 利用太阳能直接使水分解产生氢气
B. 以焦炭和水制取水煤气(含CO和H2)后分离出氢气
C. 用铁和盐酸反应放出氢气
D. 由热电站提供电力电解水产生氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为amolL﹣1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干并充分灼烧得到固体W2g.下列关系式中错误的是( )
A.24n(Al)+35.5n(Na)=W2﹣W1
B.n(Na)+3n(Al)=aV2
C.n(Na)+3n(Al)= ![]()
D.aV2= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清的石灰水变浑浊,另外测得这种气体密度为同温、同压下的氧气密度的1.375倍。B固体能溶于热苛性钠溶液,再往所得的溶液中加入过量盐酸时,析出白色胶状沉淀。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热后能得到C,C在高温时软化,无固定熔点。
根据以上事实,判断A为元素的单质,B的化学式为 , C物质为。
写出生成C的有关反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的生产步骤有:①浓缩结晶 ②加熟石灰③加盐酸 ④过滤 ⑤熔融电解,正确的生产顺序是( )
A.①②③④⑤
B.⑤④③①②
C.②④③①⑤
D.③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. 碱金属密度随核电荷数的增加逐渐增大
D. 3517Cl与3717Cl得电子能力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com