
【题目】下列实验现象预测或装置的选用正确的是 ( )

A.用装置(Ⅰ)加热草酸晶体的方法获取某些气体(草酸晶体的熔点101.5℃,分解温度约为150℃)
B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产空气污染
D.用装置(Ⅳ)分离溴苯和苯的混合物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】樱桃是一种抗氧化的水果,樱桃中含有一种羟基酸,其结构如图,下列有关该羟基酸的说法中不正确的是
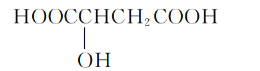
A.该羟基酸的分子式为C4H6O5
B.该羟基酸可发生氧化反应
C.该羟基酸可发生取代反应
D.0.1mol该羟基酸完全燃烧时消耗6.72L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2))是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。某课题组以惰性电极电解盐酸和NH4Cl的混合溶液获得NCl3溶液,再以NCl3溶液和NaClO2反应制得ClO2。回答下列问题:
(1)ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示:
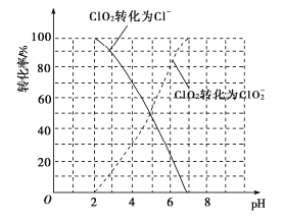
①pH≤2时,ClO2与I-反应生成I2的离子方程式为_________________。
②在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+,ClO2氧化Mn2+生成MnO2的反应中,氧化剂和还原剂的物质的量之比为________。
(2)NCl3的水解产物有NHCl2、NH2Cl等。
①NCl3的电子式为________,其中氯元素的化合价是________;NH2Cl仍可缓慢发生水解,其化学方程式为_________________。
②NCl3在NaOH溶液中水解生成N2,NaClO和NaCl,其化学方程式为______________。
③NCl3与NaClO2按物质的量之比1∶6混合,在溶液中恰好反应生成ClO2和氨,该反应的离子方程式为___________________。
(3)有下列两种方法制备ClO2:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是_______________。
(4)电解获得NCl3溶液的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓是一种广泛用于电子和通信领域的重要金属,其化学性质与铝相似。
(1)工业上提纯镓的方法有很多,其中以电解精炼法为主。具体原理如下:以待提纯的粗镓(含有Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子的氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+电解精炼镓时阳极泥的成分为________。
②GaO2— 在阴极放电的电极反应式为______。
(2)工业上利用固态Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN),同时有氢气生成。反应过程中每生成3 mol H2,放出30.8 kJ的热量。
①该反应的热化学方程式为______。
②一定条件下,一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是______(填字母)。
A. 恒温恒压下,混合气体的密度不变
B. 断裂3 mol H—H键,同时断裂2 mol N—H键
C. 恒温恒压下,反应达到平衡时,向反应体系中加入 2 mol H2,NH3的消耗速率等于原平衡时NH3的消耗速率
D. 恒温恒容下, NH3 与H2的物质的量浓度之比为2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为______(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为________。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,温度升高,Ka将______(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+) _________,Ka________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。

(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH—(aq)
Mg2+(aq)+2OH—(aq)
B.NaHS溶液中存在电离平衡:HS—+H2O![]() H2S+OH-
H2S+OH-
C.NaHCO3溶液中存在水解平衡:HCO3—+H2O![]() OH—+H2CO3
OH—+H2CO3
D.反应:Cr2O72—+ H2O![]() 2CrO42—+2H+,其平衡常数K=
2CrO42—+2H+,其平衡常数K=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液:K+、Fe3+、SO42-、Cl-
B.水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32-
C.与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42-
D.![]() = 1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3-
= 1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室对酸碱中和反应进行探究
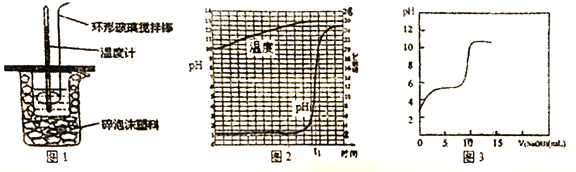
(1)中和热的测定:用50mL 0.5mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如图1所示装置中进行中和热测定,若用等体积等浓度的醋酸代替盐酸,测得中和热数值____。(填“偏大”、“偏小”或“无影响”)
(2)中和滴定:取一定量的稀盐酸,逐滴滴加NaOH溶液,边滴加边振荡。
①指示剂法:用___________(填仪器名称)取一定体积的稀盐酸于锥形瓶中,滴加几滴甲基橙作指示剂,滴定达到终点的现象为__________。
②传感器法:用传感器实时获得溶液的pH、温度曲线如图2所示,当反应达到终点时,溶液的温度为____℃。若用等浓度的醋酸代替稀盐酸,用传感器实时获得溶液的pH如图3所示,图2与图3中溶液起始pH后者较大的原因是__________,图3中反应终点时溶液pH约为8,请用离子方程式表示其原因________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com