
| A、Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | ||||
| B、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ |
| ||


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
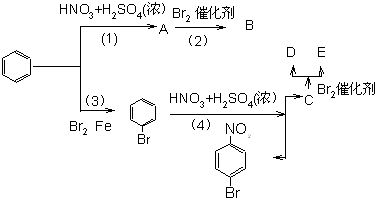
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆增大的倍数 |
| C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆减小的倍数 |
| D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加CaCO3后,溶液漂白性增强 |
| B、反应:H2(g)+I2(g)?2HI(g) 达平衡后,增大压强,气体颜色变深 |
| C、盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 |
| D、纯碱溶液在加热时,去除油污的效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24.3% | B、40% |
| C、50% | D、60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com