
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是

① 在Ni催化条件下1mol该有机物可与3mol H2发生加成;
② 该有机物不能发生银镜反应;
③ 该有机物分子式为C12H22O2;
④ 该有机物的同分异构体中不可能有酚类;
⑤ 1 mol该有机物水解时只能消耗1 mol NaOH
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:A(g)+3B(g)![]() 2C(g),有关下列图象的说法不正确的是( )
2C(g),有关下列图象的说法不正确的是( )

A. 依据图a可判断正反应为放热反应
B. 在图b中,虚线可表示使用了催化剂
C. 若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D. 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个绝热恒容的密闭容器中分别进行下列两个可逆反应:
甲:C(s)+H2O(g) ![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②气体的总物质的量不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是
A. ①③B. ④⑤C. ③④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第3周期中,置换酸中氢的能力最强的元素的元素符号为______,化学性质最稳定的元素符号是________,最高价氧化物的水化物的酸性最强的化合物的化学式是_______,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是_________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为______________________________、________________________,原子半径最大的金属元素的名称是_______________________,离子半径最小的离子结构示意图是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,r 溶于水是强酸,s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )

A.W 在周期表中所在族全是金属B.X 的最高价氧化物的水化物为强酸
C.Y 的氢化物常温常压下为气态D.1molZ 单质与氢氧化钠溶液反应转移 1mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
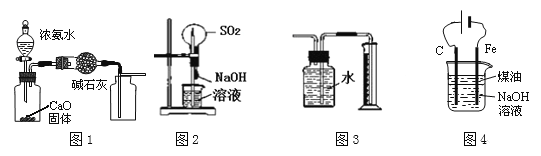
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可以完成“喷泉”实验
C.用图3装置直接测量Cu与浓硝酸反应产生的NO2体积
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能够达到实验目的的是( )

A. 实验室制取少量硝基苯 B. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C. 分离乙酸乙酯、碳酸钠和水的混合物 D. 证明乙醇浓硫酸共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是( )

①铜为阳极,锌为阴极;②铜极上有气泡;③SO42-向铜极移动;④若有0.5 mol 电子流经导线,则可产生0.25 mol气体;⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-=Cu2+。
A. ①②③ B. ②④ C. ④⑤⑥ D. ④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com