
【题目】在第3周期中,置换酸中氢的能力最强的元素的元素符号为______,化学性质最稳定的元素符号是________,最高价氧化物的水化物的酸性最强的化合物的化学式是_______,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是_________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为______________________________、________________________,原子半径最大的金属元素的名称是_______________________,离子半径最小的离子结构示意图是______。
【答案】Na Ar HClO4 NaOH Al(OH)3 Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O 钠 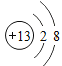
【解析】
第3周期从左到右包括的元素为Na、Mg、Al、Si、P、S、Cl、Ar,同周期从左到右原子半径逐渐减小(稀有气体除外),元素的金属性逐渐减弱、非金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱、酸性逐渐增强,则在第3周期中,置换酸中氢的能力最强的元素的元素符号为Na,化学性质最稳定的元素符号是Ar,最高价氧化物的水化物的酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式为NaOH,显两性的氢氧化物的化学式是Al(OH)3,Al(OH)3与盐酸、氢氧化钠溶液分别反应的离子方程式为Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O,原子半径最大的金属元素的名称是钠,根据“层多径大,序大径小”,离子半径最小的离子为Al3+,Al3+的离子结构示意图为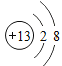 。
。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Y、Z、W的原子半径由大到小顺序为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为____________。
(3)元素W位于周期表的第_____周期第________族,其非金属性比R弱,用原子结构的知识解释原因:__________。元素W和R的气态氢化物的稳定性关系为:________(写出化学式)。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:____________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的反应方程式不正确的是( )
A. 向碳酸钠溶液中滴加酚酞溶液,溶液变红:CO32-+2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
B. 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2+ + S2-===CuS↓
C. 向AgCl沉淀中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-![]() Ag2S+2Cl-
Ag2S+2Cl-
D. 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中溶液变蓝:4H++4I-+O2=== 2I2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是( )

A.该反应的化学方程式为2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等.工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:

(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为___,每产生32g Fe2O3,转移电子的物质的量为_______,该步骤不能使用陶瓷容器,原因是_______。
8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为___,每产生32g Fe2O3,转移电子的物质的量为_______,该步骤不能使用陶瓷容器,原因是_______。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为___________,滤渣中除Al(OH)3外还有_______(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全 (已知:离子浓度小于1×10-5mol/L时沉淀就达完全, Cr(OH)3的Ksp=1.0×10-32)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的干馏实验装置如图所示。下列说法错误的是( )

A.c口导出的气体可使新制氯水褪色B.从b层液体中分离出苯的操作是分馏
C.长导管的作用是导气和冷凝D.可用蓝色石蕊试纸检验a层液体中含有的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(mol/L) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中H2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com