
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(mol/L) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中H2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【答案】A
【解析】
在恒容密闭环境下,增大反应物浓度,平衡正向移动,以甲容器为标准,乙容器增大氢气浓度,二氧化碳转化率升高,氢气转化率下降;丙容器同时扩大两气体浓度,产物浓度增大,反应物转化率不变。
以甲容器为准,设反应产生水xmol。
H2(g)+CO2(g)![]() H2O(g)+CO(g)
H2O(g)+CO(g)
反应前 0.01 0.01 0 0
反应中 x x x x
反应后 0.01-x 0.01-x x x
平衡常数=![]() ,故x=0.006,氢气转化率为60%。
,故x=0.006,氢气转化率为60%。
A. 平衡时,乙中增大氢气浓度,H2的转化率下降,小于60%,A错误;
B. 平衡时,丙等比例添加反应物,转化率不变,甲中和丙中H2的转化率均是60%,B正确;
C. 平衡时,丙等比例添加反应物,转化率不变,丙中c (CO)是甲中的2倍,是0.012 mol/L,C正确;
D. 反应物浓度越高,反应速率越快,故反应开始时,丙中的反应速率最快,甲中的反应速率最慢,D正确;
答案为A。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】在第3周期中,置换酸中氢的能力最强的元素的元素符号为______,化学性质最稳定的元素符号是________,最高价氧化物的水化物的酸性最强的化合物的化学式是_______,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是_________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为______________________________、________________________,原子半径最大的金属元素的名称是_______________________,离子半径最小的离子结构示意图是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2B溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ表示H2B,Ⅱ代表HB-、Ⅲ代表B2-),根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是
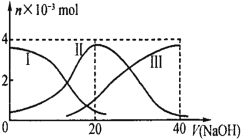
A. c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B)
B. c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(H+)>c(B2-)
C. c(Na+)>c(H+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
D. c(Na+)>c(OH-)>c(HB-)>c(H2B)>c(H+)>c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
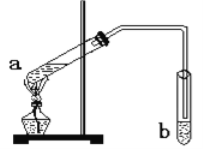
(1)写出试管a中发生的化学方程式:_____________________________________;
(2)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是 ________________;
(3)浓硫酸的作用为___________________________________________________;
(4)试管b中所盛的溶液为________________,其主要作用是 _________________________。
(5)分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行:
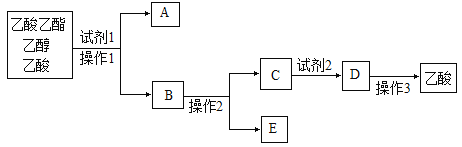
①试剂1最好选用_________________,
②操作1是________________,所用的主要仪器名称是_______________;
③操作2是_____________,试剂2最好选用_______________,操作3是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是( )

①铜为阳极,锌为阴极;②铜极上有气泡;③SO42-向铜极移动;④若有0.5 mol 电子流经导线,则可产生0.25 mol气体;⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-=Cu2+。
A. ①②③ B. ②④ C. ④⑤⑥ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体粉末,其中可能含有Na2CO3、NH4NO3、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有_______;一定不含有______,可能含有_______。
(2)如要检验其是否存在,将如何操作______。请写出相应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶液可制得“84消毒液”,用电子式表示“84消毒液”的有效成分是__________。
(2)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,也可用于自来水的杀菌消毒。工业上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com