
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
【答案】2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=-759.8kJ/mol K=K3K12/K2 0.008mol/(L·s)
N2(g)+2CO2(g) △H=-759.8kJ/mol K=K3K12/K2 0.008mol/(L·s)
【解析】
本题考查热化学方程式的书写及盖斯定律的应用、化学反应速率、化学平衡常数。
(1)由已知信息可以求出热化学方程式①NO2(g) + CO(g)![]() CO2(g) + NO(g)ΔH=812 kJ·mol-1+1076 kJ·mol-1-1490 kJ·mol-1-632 kJ·mol-1=-234 kJ·mol-1。NO与CO反应生成无污染气体,根据质量守恒定律可知无污染气体为N2和CO2,写出热化学方程式2NO(g)+2CO(g)
CO2(g) + NO(g)ΔH=812 kJ·mol-1+1076 kJ·mol-1-1490 kJ·mol-1-632 kJ·mol-1=-234 kJ·mol-1。NO与CO反应生成无污染气体,根据质量守恒定律可知无污染气体为N2和CO2,写出热化学方程式2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)ΔH,根据盖斯定律,由①×2-②+③可得目标热化学方程式,则ΔH=-234kJ·mol-1×2-(+179.5 kJ·mol-1)+(-112.3kJ·mol-1)=-759.8 kJ·mol-1。当总反应式相加时,平衡常数相乘,相减时相除,成倍时为幂,则该反应的平衡常数
N2(g)+2CO2(g)ΔH,根据盖斯定律,由①×2-②+③可得目标热化学方程式,则ΔH=-234kJ·mol-1×2-(+179.5 kJ·mol-1)+(-112.3kJ·mol-1)=-759.8 kJ·mol-1。当总反应式相加时,平衡常数相乘,相减时相除,成倍时为幂,则该反应的平衡常数![]() 。
。
(2)因为压强之比等于物质的量之比,又由于在1L密闭容器(恒容容器)中进行的反应,则压强之比又等于物质的量浓度之比,即反应前后总浓度之比为29/30,可求出CO浓度的变化量,再根据速率公式计算CO的速率。
(1)根据焓变=反应物的总键能-生成物的总键能,可以求出热化学方程式①NO2(g) + CO(g) ![]() CO2(g) + NO(g)ΔH=812 kJ·mol-1+1076 kJ·mol-1-1490 kJ·mol-1-632 kJ·mol-1=-234 kJ·mol-1,②N2(g)+O2(g)
CO2(g) + NO(g)ΔH=812 kJ·mol-1+1076 kJ·mol-1-1490 kJ·mol-1-632 kJ·mol-1=-234 kJ·mol-1,②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5 kJ /mol,③2NO(g) + O2(g)
2NO(g) △H=+179.5 kJ /mol,③2NO(g) + O2(g) ![]() 2NO2(g)△H=-112.3kJ/mol,根据盖斯定律,由①×2-②+③可得目标热化学方程式,则ΔH=-234 kJ·mol-1×2-(+179.5 kJ·mol-1)+(-112.3 kJ·mol-1)=-759.8 kJ·mol-1。当总反应式相加时,平衡常数相乘,相减时相除,成倍时为幂,则该反应的平衡常数
2NO2(g)△H=-112.3kJ/mol,根据盖斯定律,由①×2-②+③可得目标热化学方程式,则ΔH=-234 kJ·mol-1×2-(+179.5 kJ·mol-1)+(-112.3 kJ·mol-1)=-759.8 kJ·mol-1。当总反应式相加时,平衡常数相乘,相减时相除,成倍时为幂,则该反应的平衡常数![]() 。本小题答案为:2NO(g)+2CO(g)
。本小题答案为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-759.8kJ/mol;K=K3K12/K2。
N2(g)+2CO2(g) △H=-759.8kJ/mol;K=K3K12/K2。
(2)设达到平衡时NO2的浓度改变为x
2NO2+4CO![]() 4CO2+N2
4CO2+N2
起始浓度(mol/L) 0.1 0.2 0 0
改变浓度(mol/L) x 2x 2x 0.5x
平衡浓度(mol/L) 0.1-x 0.2-2x 2x 0.5x,则[(0.1-x)+(0.2-2x)+0.2x+0.5x]/(0.1+0.2)=29/30,得x=0.02mol/L,v(CO)=( 2×0.02mol/L)/5s=0.008mol/(L·s)。本小题答案为:0.008mol/(L·s)。


科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如右图所示。据图分析,下列判断错误的是

A. Ksp[Fe(OH)3]< Ksp [Cu(OH)2]
B. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(mol/L) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中H2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
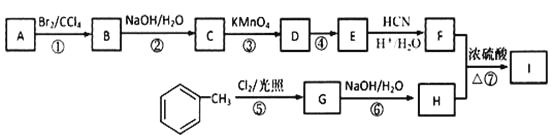
已知:①A 属于脂肪烃,核磁共振氢谱显示有 2 组峰,面积比为 3:1,其蒸气密度是相同条件下 H2 的 28 倍;D 分子式为C4H8O3;E 分子式为 C4H6O2,能使溴水褪色。
②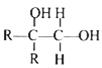
![]()
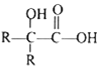 其中 R 为烃基。
其中 R 为烃基。
③![]()
![]()
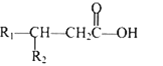 其中 R1 和 R2 均为烃基。
其中 R1 和 R2 均为烃基。
回答下列问题:
(1)A 的结构简式为_______。
(2)D 中官能团的名称是_______。
(3)反应②化学方程式为_______。
(4)E的同系物K 比E 多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是_______ (填序号)。
(6)反应⑦的化学方程式为_______。
(7)参照上述合成路线,以![]() 原料(无机试剂任选),经 4 步反应制备可降解塑料
原料(无机试剂任选),经 4 步反应制备可降解塑料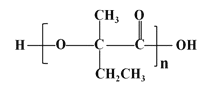 _______ (例如合成流程CH3CH2Br
_______ (例如合成流程CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3)
CH3COOCH2CH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等息息相关,下列说法中正确的是( )
A.“华为P30 Pro”手机中麒麟芯片的主要成分是二氧化硅
B.赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。“灿烂美丽的烟花是某些金属的焰色反应,焰色反应属于物理变化
C.我国自主研发的东方超环(人造太阳)使用的 2H、3H与 1H互为同素异形体
D.熔喷布是医用口罩最核心的材料,熔喷布主要以聚丙烯为主要原料,其结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料,按要求回答问题:酒精、苯(密度小于水,且不溶于水)、CCl4都是有机溶剂,液溴Br2和碘(I2)皆难溶于水,都易溶于上述有机溶剂。
(1)在酒精、苯、NaCl溶液3种试剂中:能把溴单质从溴水中萃取出来的是________,萃取时上层液体呈________色,下层液体呈________色。
(2)乙醇和乙酸可以互溶,若要分离两者,可通过蒸馏实现,请指出图中实验装置中的错误之处:①________________;②______________;③________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种常见元素的性质或结构如下表:
X | 与Al同周期,金属性最强 |
Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
W | 单质紫黑色,遇淀粉溶液显蓝色 |
(1)X元素的名称是___;Y的原子结构示意图是___;W在元素周期表中的位置是___;
(2)请写出Z的单质与X元素最高价氧化物所对应水化物的溶液在常温下反应的离子方程式___;
(3)判断非金属性Z___Y(填“>”或“<”),请用离子方程式进行说明:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅥⅠA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)表中能形成两性氢氧化物的元素是______(用元素符号表示),写出该元素与⑨最高价氧化物的水化物反应的化方程式______。
(3)用电子式表示④元素与⑦元素形成化合物的过程______。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是______(填化 学式)。
(5)②的气态氢化物与最高价氧化物对应的水化物反应的离子方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com