
【题目】能区别NaCl,AgNO3,Na2CO3三种溶液的最适宜的试剂为( )
A.氯化钙B.氢氧化钠溶液C.稀硝酸D.稀盐酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
A. 原子个数之比为1:1B. 物质的量之比为1:1
C. 体积之比为11:16D. 分子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是( )
A.Al(OH)3难溶于水,不属于电解质B.H2SiO3、H2SO3都是弱酸
C.Na2O2为碱性氧化物D.浓硫酸、液氯均属于分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
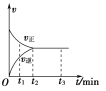
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2CH2OH和CH3CH2OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学专家侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
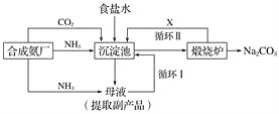

(1)上述生产纯碱的方法称__________,副产品的一种用途为______________。
(2)沉淀池中发生的化学反应方程式是______________。
(3)写出上述流程中X物质的分子式______________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
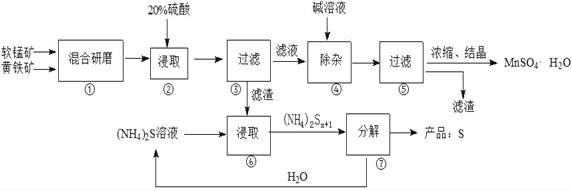
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到过量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中错误的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100ml
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C. 参加反应的金属的总质量为9.6g>m>3.6g
D. 当金属全部溶解时收集到NO气体的体积在标准状况下一定为2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com