
| 20.02mL+19.98mL |
| 2 |
| 0.56g |
| 5g |
| (510+18x)a% |
| 18 |
| 5.1a |
| 18(1-a%) |
| 5.1a |
| 18(1-a%) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、16O与18O互为同分异构体 |
| B、16O与18O核外电子排布不同 |
| C、通过化学变化可以实现16O与18O间的转化 |
| D、标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 | |
| ①组 | 40℃ | 10ml | 10ml | 40s |
| ②组 | 40℃ | 20ml | 20ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
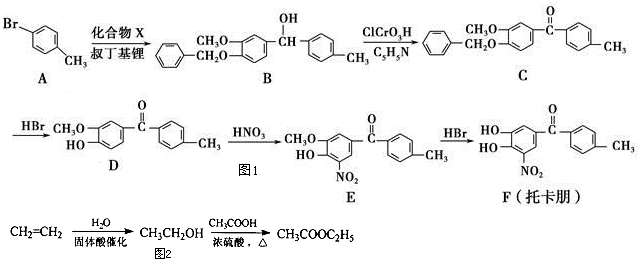
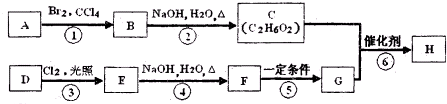
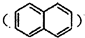 的衍生物,且取代基都在同一个苯环上;
的衍生物,且取代基都在同一个苯环上;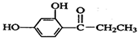 是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和
是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和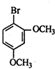 为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2:
为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 | 0.4 |
| 3 | 4 |
| 3 | 6 |
| 3 | 60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com