
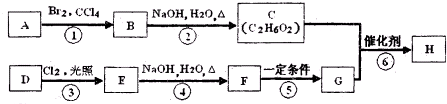
| 166×57.8% |
| 12 |
| 166×3.6% |
| 1 |
| 166-12×8-6 |
| 16 |
 ,由转化关系可知,F为
,由转化关系可知,F为 ,E的结构简式为:
,E的结构简式为: ,D为
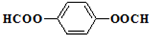
,D为 ,乙二醇和对二苯甲酸反应生成聚酯纤维H为
,乙二醇和对二苯甲酸反应生成聚酯纤维H为 ,据此解答.
,据此解答. ,由转化关系可知,F为
,由转化关系可知,F为 ,E的结构简式为:
,E的结构简式为: ,D为
,D为 ,乙二醇和对二苯甲酸反应生成聚酯纤维H为
,乙二醇和对二苯甲酸反应生成聚酯纤维H为 ,
, ,故答案为:1,2-二溴乙烷;
,故答案为:1,2-二溴乙烷; ;
;| H2O |
| △ |
 与氯气在光照条件下反应生成
与氯气在光照条件下反应生成 ,反应的反应方程式为:
,反应的反应方程式为: +Cl2
+Cl2| 光照 |
 +2HCl;
+2HCl; ,
,| H2O |
| △ |
 +Cl2
+Cl2| 光照 |
 +2HCl;
+2HCl; ;
; )有多种同分异构体,同时符合下列条件的同分异构体:a.含有苯环且苯环上只有2个取代基,b.能与NaOH溶液反应,含有酚羟基,c.在Cu催化下与O2反应的产物能发生银镜反应,含有醇羟基,符合条件的同分异构体有:
)有多种同分异构体,同时符合下列条件的同分异构体:a.含有苯环且苯环上只有2个取代基,b.能与NaOH溶液反应,含有酚羟基,c.在Cu催化下与O2反应的产物能发生银镜反应,含有醇羟基,符合条件的同分异构体有: ,
, (任选一种).
(任选一种).


科目:高中化学 来源: 题型:
| A、K+、HCO3-、Na+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、Ba2+、NO3-、Cl-、K+ |
| D、Ca2+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,生产过程如图:
,生产过程如图:
 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤ | B、①④ | C、②③⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,R、R′均为烃基
,R、R′均为烃基查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B、常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小 |
| C、NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) |
| D、等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,
在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com