
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( ) 
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中CuO的质量为4.0g
C.V=448
D.原样品中Fe元素的质量分数为41%
【答案】C
【解析】解:A.由于氧化性Fe3+>Cu2+>H+ , 铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为Fe2+、H+ , 故A错误; B.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为 ![]() =0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故B错误;
=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故B错误;
C.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3 , 其物质的量= ![]() =0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4 , 说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量
=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4 , 说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量 ![]() =0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol﹣0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故C正确;
=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol﹣0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故C正确;
D.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,故合金中Fe元素质量分数= ![]() ×100%=38.89%,故D错误,
×100%=38.89%,故D错误,
故选C.


科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) | 该反应的△H<0 |
C | 常温下,Ksp(AgCl)=1.8×10﹣10、 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时, |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1﹣苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1﹣苯乙醇的反应原理(图1)、装置(图2)和有关数据如表:
试剂 | 熔点(℃) | 沸点(℃) | 密度(gcm﹣3) | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1﹣苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | ﹣ | ﹣ | 1.076 | 溶 | 溶 | 不溶 |
乙醚 | ﹣116.3 | 34.6 | 0.713 | 微溶 | 溶 | ﹣ |
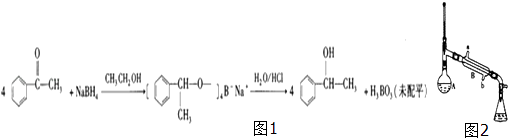
实验步骤:①在烧杯中加入15mL 95%的乙醇和0.1g硼氢化钠,搅拌下,再滴入8mL苯乙酮,控制温
度在48℃~50℃,滴加完毕,室温下放置15min.
②在搅拌的条件下,慢慢滴加6mL 3mol/L的盐酸.
③水浴加热,使反应液中大部分乙醇蒸出,出现分层,再加入10mL乙醚.将混合反应液倒入分液漏
斗,分离上述液体,水层再用10mL乙醚萃取,合并两次分液得到的有机相.
④加入适量无水硫酸镁,静置片刻,过滤除去硫酸镁固体.再加入0.6g无水碳酸钾,然后进行简单蒸
馏除去乙醚.
⑤经减压蒸馏得到1﹣苯乙醇4.5g(减压蒸馏可降低有机物的沸点).
(1)反应中加入乙醇的目的是 .
(2)反应完成后,蒸出大部分乙醇,反应液出现分层,上层为(填“水层”或“有机层”,下同),加入10mL乙醚,充分振荡后,上层为 .
(3)装置中仪器A的名称为 , 在本实验中最好选用的规格是(填“50mL”、“100mL”或“200mL”);仪器B中冷凝水由(填“a”或“b”)口流出.
(4)步骤④中加入无水硫酸镁的作用是 .
(5)步骤④蒸馏除去乙醚时,应采用的最佳加热方式为(填字母序号)a.酒精灯加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液的离子浓度关系正确的是( )
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH﹣)+c( HC2O4﹣)
B.Na2S溶液:c(Na+)>c(HS﹣)>c(OH﹣)>c(H2S)
C.NaHSO4溶液:c(H+)=c(SO ![]() )十c(OH﹣)
)十c(OH﹣)
D.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl﹣)>c(H+)>c(NH ![]() )>c(OH﹣)
)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.由图中所给数据进行分析: 
(1)该反应的化学方程式为;
(2)反应从开始至2分钟末,用Z表示该反应的平均反应速率;
(3)反应达平衡时X的转化率: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的CO2和NH3相比,下列说法不正确的是
A. 常温常压下,体积之比为1:1 B. 分子数之比为1:1
C. 原子数之比为1:1 D. 质量之比为44:17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25gL﹣1 . D的分子式为C4H8O2 , D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如下转化关系: 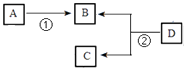
请回答下列问题:
(1)写出D的结构简式: .
(2)写出过程①的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500﹣600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁.现用如图所示的装置模拟上述过程进行试验.回答下列问题: 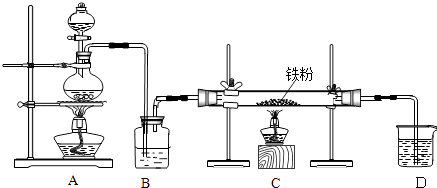
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 , 装置B中加入的试剂是 .
(2)制取无水氯化亚铁的实验中,装置A用来制取 . 尾气的成分是 . 若仍用D的装置进行尾气处理,存在的问题是、 .
(3)若操作不当,制得的FeCl2 会含有少量FeCl3 , 检验FeCl3常用的试剂是 . 欲制得纯净的FeCl2 , 在实验操作中应先点燃处的酒精灯,目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com