
【题目】室温下,下列溶液的离子浓度关系正确的是( )
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH﹣)+c( HC2O4﹣)
B.Na2S溶液:c(Na+)>c(HS﹣)>c(OH﹣)>c(H2S)
C.NaHSO4溶液:c(H+)=c(SO ![]() )十c(OH﹣)
)十c(OH﹣)
D.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl﹣)>c(H+)>c(NH ![]() )>c(OH﹣)
)>c(OH﹣)
【答案】C
【解析】解:A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,根据电荷守恒可得:c(Na+)+c(H+)=c(OH﹣)+2c(C2O42﹣)+c(HC2O4﹣ ),故A错误;
B.Na2S溶液中,硫离子部分水解,溶液呈碱性,由于氢氧根离子来自水的电离和硫离子水解,则c(OH﹣)>c(HS﹣),溶液中正确的离子浓度大小为:c(Na+)>c(OH﹣)>c(HS﹣)>c(H2S),故B错误;
C.NaHSO4溶液中,根据电荷守恒可知:c(H+)+c(Na+)=2c(SO ![]() )+c(OH﹣),根据物料守恒c(Na+)=c(SO
)+c(OH﹣),根据物料守恒c(Na+)=c(SO ![]() )可知c(H+)=c(SO
)可知c(H+)=c(SO ![]() )+c(OH﹣),故C正确;
)+c(OH﹣),故C正确;
D.pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,所以c(OH﹣)>c(H+),溶液中存在电荷守恒c(NH ![]() )+c(H+)=c(Cl﹣)+c(OH﹣),所以得c(NH
)+c(H+)=c(Cl﹣)+c(OH﹣),所以得c(NH ![]() )>c(Cl﹣),溶液中一水合氨电离程度较小,所以c(Cl﹣)>c(OH﹣),则溶液中离子浓度大小顺序是c(NH
)>c(Cl﹣),溶液中一水合氨电离程度较小,所以c(Cl﹣)>c(OH﹣),则溶液中离子浓度大小顺序是c(NH ![]() )>c(Cl﹣)>c(OH﹣)>c(H+),故D错误;
)>c(Cl﹣)>c(OH﹣)>c(H+),故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
0~10min内,CO2的平均反应速率v(CO2)= , 反应进行到30min时,NO 的转化率= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组拟制备氯气并验证其一系列性质.Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色.
②硫代硫酸钠溶液在工业上可作为脱氯剂.
(1)Ⅱ.【性质验证】实验装置如图1所示(省略夹持装置)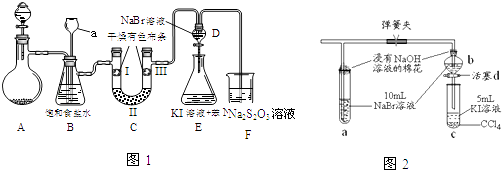
实验步骤:
a.检查装置气密性,按图2加入试剂.仪器a的名称是;装置CⅡ处加的试剂可以是(选填下列字母编号).
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
b.装置B的作用有 .
c.写出装置F中相应的离子反应方程式: .
(2)Ⅲ.【探究与反思】a.图1中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是 . 该组的同学思考后将上述D、E、F装置改为实验操作步骤如下:
①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹.
③当a中溶液由黄色变为棕色时,停止通氯气.
④ .
b.设计步骤③的实验思想是 .
c.步骤④的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的大量废玻璃粉末中含有二氧化铈(CeO2).
(1)①煅烧Ce(OH)CO3可制备CeO2 , 配平该反应的化学方程式Ce(OH)CO3+O2=CeO2+CO2+H2O
②已知在一定条件下,电解熔融状态的CeO2可制备Ce,在阴极获得铈,写出阴极的电极反应式;
(2)某课题组以上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其他少量不溶于稀酸的物质)为原料,设计如图1流程对资源进行回收,得到Ce(OH)4和硫酸铁铵.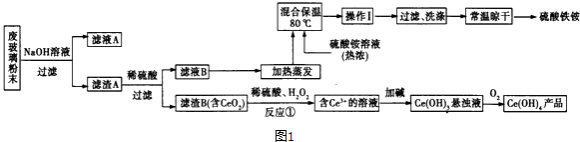
①得到滤渣B时,需要将其表面杂质洗涤干净.检验滤渣B已经洗涤干净的方法是 .
②反应①的离子方程式为 .
③如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.
该产品中Ce(OH)4的质量分数为(保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度(“偏高”、“偏低”或“无影响”).
(3)操作I的名称是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
A.配制0.10molL﹣1NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2 , 分出水层后的操作 | D.记录滴定终点读数为12.20mL |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( ) 
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中CuO的质量为4.0g
C.V=448
D.原样品中Fe元素的质量分数为41%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环是有机合成的重要环节.如反应①化合物(Ⅰ)可由(Ⅲ)合成: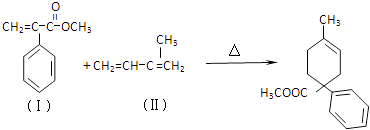
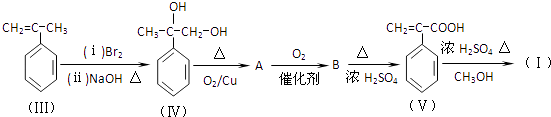
(1)(Ⅰ)的分子式为 , 1mol(Ⅰ)最多能与molH2发生加成反应.
(2)写出(Ⅳ)→A的化学方程式 .
(3)酸性条件下,化合物B能发生聚合反应,化学方程式为 .
(4)化合物B→(Ⅴ)的反应类型为 .
(5)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为(任写一种)
(6)下列物质与(Ⅴ)互为同分异构体的是(填序号)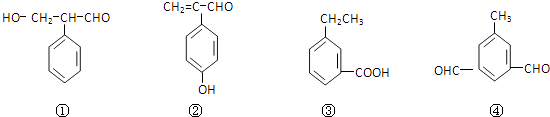
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com