
【题目】某单烯烃与足量氢气加成产物的分子式为C5H12,该烯烃的结构(不含立体异构)有
A. 3种 B. 4种 C. 5种 D. 6种
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】关于下图所示①、②两个装置的叙述中,正确的是( )

A.硫酸浓度变化:①增大,②减小
B.装置名称:①是原电池,②是电解池
C.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中正极:Zn-2e-===Zn2+
D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
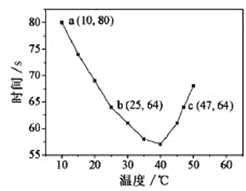
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
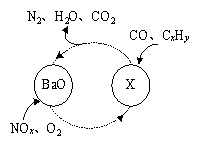
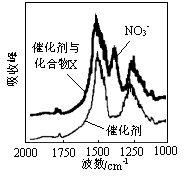
图1 图2
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②氮元素在周期表中的位置是 。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式: 。已知NOx与NH3的反应△H<0,为提高氮氧化物的转化率可采取的措施是 (任写一条)。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是 。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是 。
③若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为2 mol·L-1的次氯酸钠的体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对乙烯和聚乙烯的描述中,不正确的是( )
A.乙烯是纯净物,聚乙烯是混合物
B.常温下,乙烯为气态,聚乙烯为固态
C.乙烯的化学性质与聚乙烯相同
D.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
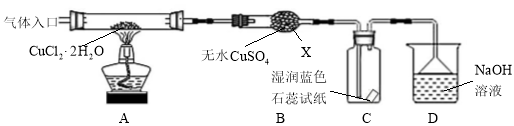
请回答下列问题:
(1)仪器X的名称是________________。
(2)实验操作的先后顺序是① → → → → ⑤。
①检查装置的气密性后加入药品
②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl
④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生反应的离子方程式是 。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
(6)若已证实杂质为CuO,请写出由Cu2(OH)2Cl 2生成CuO的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别物质的方法错误的是( )
A. 用酚酞鉴别食盐水和稀醋酸
B. 用水鉴别生石灰和石灰石
C. 用燃着的木条鉴别空气和二氧化碳
D. 用氯化钡溶液鉴别稀盐酸和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质。通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/L r溶液的![]() 为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
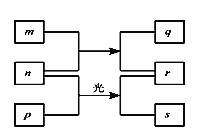
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.![]() 的氢化物常温常压下为气态
的氢化物常温常压下为气态
D.![]() 的最高价氧化物对应的水化物为弱酸
的最高价氧化物对应的水化物为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,化学性质稳定,用途广泛。 工业上以铬铁矿[主要成分是 Fe(CrO2)2]为原料冶炼铬及获得强氧化性 Na2Cr2O7,其工艺流程如下图所示:
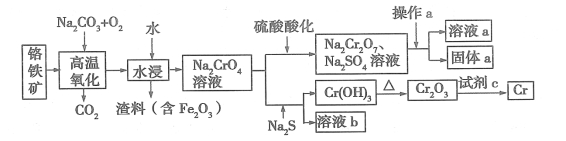
 (1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(2)写出利用铝热反应制取铬的化学方程式: ,试剂 c 通常还可以是 (至少写两种) 。
(3)酸化过程中,不选用盐酸的原因是 。
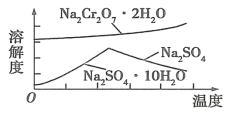
(4)固体 a 的主要成分是 Na2SO4·10H2O,根据图分析,操作a为 、 、过滤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com