
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
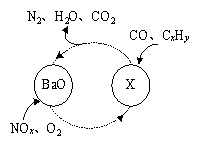
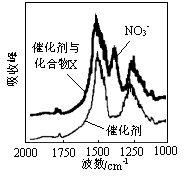
图1 图2
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②氮元素在周期表中的位置是 。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式: 。已知NOx与NH3的反应△H<0,为提高氮氧化物的转化率可采取的措施是 (任写一条)。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是 。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是 。
③若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为2 mol·L-1的次氯酸钠的体积为 mL。
【答案】(1)①N、O (2分) Ba(NO3)2 (1分) ②第二周期第ⅤA族(1分)
(2)16NH3+12NO+6NO2=17N2+24H2O(2分) 增大NH3浓度(降低温度)(1分)
(3)2NO2+4SO32-=N2+4SO42-(2分) (4)①![]() (1分)
(1分)
②取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+(2分) ③30(2分)
【解析】
试题分析:(1)①根据图示可知,在图示的转化中,NOx中的N元素的化合价部分降低,O2中的O元素的化合价降低,得到电子,被还原;所以被还原的元素是N、O;其中的部分NOx中的N元素的化合价部分升高,变为HNO3,与BaO发生反应,形成Ba(NO3)2,所以形成的X的化学式为Ba(NO3)2;②氮元素在周期表中的位置是第二周期第ⅤA族;
(2)SCR技术可使NOx与NH3的直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,根据电子守恒、原子守恒,可得发生反应的化学方程式是16NH3 + 12NO + 6NO2 = 17N2 + 24H2O;已知NOx与NH3的反应△H<0,所以为提高氮氧化物的转化率可采取的措施是增大NH3浓度(降低温度);
(3)NO2氧化亚硫酸钠的离子方程式为2NO2 + 4SO32- = N2 + 4SO42- ;
(4)①次氯酸钠是离子化合物,的电子式为![]() 。
。
②氨气是碱性气体,则检验铵根的方法是:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+。
③若处理废水产生了0.448 L N2(标准状况),反应中转移电子的物质的量是![]() =0.12mol。氯元素的化合价从+1价降低到-1价,得到2个电子,所以根据电子得失守恒可知需要0.06mol次氯酸钠,溶液的体积为0.06mol÷2mol·L-1=0.03L=30mL。
=0.12mol。氯元素的化合价从+1价降低到-1价,得到2个电子,所以根据电子得失守恒可知需要0.06mol次氯酸钠,溶液的体积为0.06mol÷2mol·L-1=0.03L=30mL。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2恰好使溶液恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
A. 0.4mol B. 0.3 mol C. 0.2 mol D. 0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修物质结构与性质】
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于 区,单质X的晶体类型为 ,其中X原子的配位数为 。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为 ,其同周期元素中,第一电离能最大的是________________(写元素符号)。元素Y的含氧酸中,酸性最强的是_____________(写化学式),该酸根离子的立体构型为_____________。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(5)X与Y形成的一种化合物的立方晶胞如图所示。

该化合物的化学式为_______________,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是 cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
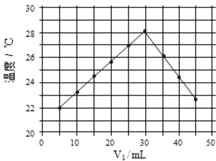
A. 做该实验时环境温度为22℃ B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=aKJ ·mol-1
2Fe(s)+3CO2(g) △H=aKJ ·mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJ·mol-1
则a= kJ·mol-1。
(2)冶炼铁反应的平衡常数表达式K= ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | ||
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 | |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 | |
甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲、乙容器中,CO的平衡浓度之比为2:3
c.增加Fe2O3可以提高CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是 ( )
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7NA /22.4
B.1 mol甲基(—CH3)所含的电子总数为9NA
C.0.5 mol 1,3 -丁二烯分子中含有碳氢键数为3 NA
D.28g丙烯所含共用电子对数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2 L的密闭容器中,发生如下反应:![]() ,经5 min后,测得D的浓度为0.5 molL-1,
,经5 min后,测得D的浓度为0.5 molL-1,![]() ,
,
C的平均反应速率是0.1 molL-1min-1
求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com