
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
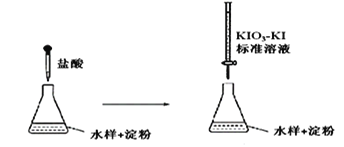
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
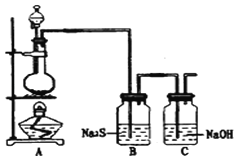
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
【答案】还原2H++S2O32-=SO2+S↓+H2O溶液由蓝色变为无色且30秒内不变色偏大10x浓盐酸淡黄色沉淀生成吸收氯气,避免空气污染
【解析】
(1)红酒中添加一定量的SO2可以防止酒液氧化,作还原剂;(2)根据现象写出离子方程式;(3)①碘单质具有氧化性,且淀粉遇碘变蓝;②通过分析消耗标准液的多少分析误差;③消耗1mL标准溶液相当于SO32-的质量1g,100mL水样相当于SO32-的质量xg,以此计算; (4) ①从实验室制取氯气的原理分析;②氯气与硫化钠反应生成硫与硫化钠;③碱液吸收尾气。
详解: (1)红酒中添加一定量的SO2可以防止酒液氧化,作抗氧化剂,体现其还原性,因此,本题正确答案是:还原;
(2)在酸性条件下,溶液中的H+与S2O32-发生反应: 2H++S2O32-=SO2+S↓+H2O,因此,本题正确答案是: 2H++S2O32-=SO2+S↓+H2O。
(3)①KIO3 和KI 在盐酸作用下析出I2,生成的I2遇淀粉溶液变蓝,因此滴定到终点时的现象是: 溶液由蓝色变为无色且30秒内不变色;
② 盛标准液的滴定管没有用标准液润洗,则标准液被稀释,滴定时消耗标准液的体积偏大,则测定结果将偏大。
③消耗1mL标准溶液相当于SO32-的质量1g,100mL水样相当于SO32-的质量xg,,则该水样中SO 32- 的含量为![]() =10x g / L
=10x g / L
因此,本题正确答案是: 溶液由蓝色变为无色且30秒内不变色;偏大 ;10x
(4)①为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸。故答案为:浓盐酸;
②在B中发生氯气置换出硫的反应,化学方程式为:Na2S+Cl2=2NaCl+S↓。故答案为:有淡黄色沉淀生成;


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】下列说法或操作正确的是
A.蒸馏过程中,冷凝管中冷却水的流向是上进下出
B.蒸发时,要不断用玻璃棒搅拌,当溶液蒸干后,应立即停止加热
C.碘易溶于酒精,可用酒精从饱和碘水中萃取碘
D.分液时下层液体从分液漏斗下口放出,上层液体从分液漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了验证苯酚、醋酸和碳酸的酸性强弱,设计了如图所示实验装置。
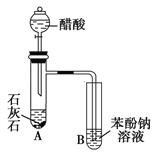
请回答下列问题:
(1)仪器B中的实验现象:____________________________________________。
(2)仪器B中发生反应的化学方程式是___________________________。
(3)该实验设计不严密,请改正:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子的球棍模型,该有机物中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是
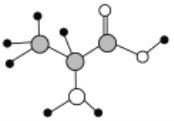
A. 分子式为C3H7O2N
B. 该有机物只能与NaOH溶液反应,不能与盐酸反应
C. 能通过聚合反应生成高分子化合物
D. 其同分异构体中有物质既不能与NaOH溶液反应,又不能与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
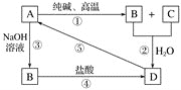
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
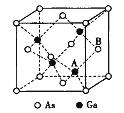
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) ① 25℃时,NH4Cl溶液呈酸性,原因是______水解引起的(填“NH4+”或“Cl-”);
② 常温下,0.0100mol/L NaOH溶液的pH=___________;
③ 用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为_______(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_________(填“AgCl”或“Ag2S”)。
(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。
回答下列:
① 该反应的热化学方程式是______________ ;
② 该反应达到平衡后,升高温度平衡向_______ (填“正”、“逆”)反应方向移动;加入催化剂平衡________(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是___________。
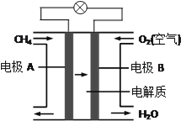
(3)燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 ________(填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:______________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 表示的分子式______;结构简式是______。
表示的分子式______;结构简式是______。
(2)![]() 中含有的官能团的名称为____________。
中含有的官能团的名称为____________。
(3)![]() 命名:_____________。
命名:_____________。
(4)写出乙醇在铜做催化剂的情况下被氧化成乙醛的化学方程式:________
(5)![]() 的分子式为______;
的分子式为______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
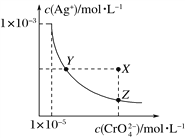
A. t ℃时,Ag2CrO4的Ksp为1×10-8;
B. t ℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀;
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等;
D. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为Z点;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com