
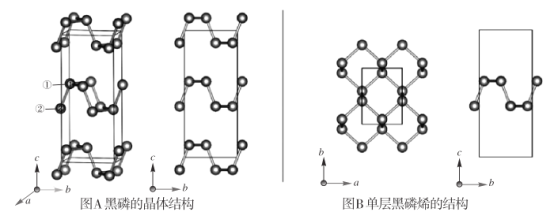
【题目】黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A。,c=10.500A。。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位 P,所有P原子的成键环境一样,图 A中编 号为①的 P原子的晶胞内坐标为(0.500,0.090,0.598)。请回答下列问题:
(1)写出基态P原子的价电子排布图:  __________。
__________。
(2)P和 F的电负性大小顺序是 x(P)______x(F)。(填 “<” “ =” 或 “ >” )P和 F形成的分子 PF3和PF5,它们的几何构型分别为__________、__________。
(3)①黑磷中 P原子杂化类型是__________。黑磷中不存在__________(选填字母序号)。
A 共价键 B σ键 C π键 D 范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__________,原因是___________。
(4)图 A中编号为②的 P原子的晶胞内坐标为_______,黑磷的晶胞中含有________个 P原子。
【答案】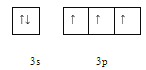 < 三角锥 三角双锥 sp3 C 黑磷>红磷>白磷 黑磷相当于石墨,属于混合晶体;红磷和白磷都是分子晶体,红磷是大分子,白磷是小分子,分子量越大,范德华力越大,熔沸点越高 (0.500,-0.090,0.402) 8
< 三角锥 三角双锥 sp3 C 黑磷>红磷>白磷 黑磷相当于石墨,属于混合晶体;红磷和白磷都是分子晶体,红磷是大分子,白磷是小分子,分子量越大,范德华力越大,熔沸点越高 (0.500,-0.090,0.402) 8
【解析】
(1)基态P原子核外有15个电子,排布式为1s22s22p63s23p3,其价电子排布图为: ,故答案为:
,故答案为: ;
;
(2)原子半径P>F,则电负性P<F,P和F形成的分子PF3和PF5,PF3价电子对数=![]() ,含有1对孤对电子,几何构型为三角锥形,PF5的价电子对数=
,含有1对孤对电子,几何构型为三角锥形,PF5的价电子对数=![]() ,不含有孤对电子,其几何构型为三角双锥形,故答案为:<;三角锥形;三角双锥形;
,不含有孤对电子,其几何构型为三角双锥形,故答案为:<;三角锥形;三角双锥形;
(3)①已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样,P的配位数为3,则价电子对数= ![]() ,其杂化方式为sp3,黑磷中P和P原子之间的作用力为σ键,层与层之间存在着范德华力,晶体中不存在π键,故答案为:sp3;C;
,其杂化方式为sp3,黑磷中P和P原子之间的作用力为σ键,层与层之间存在着范德华力,晶体中不存在π键,故答案为:sp3;C;
②黑磷相当于石墨,属于混合晶体;红磷和白磷都是分子晶体,红磷是大分子,白磷是小分子,分子量越大,范德华力越大,熔沸点越高,所以熔点:黑磷>红磷>白磷,故答案为:黑磷>红磷>白磷;黑磷相当于石墨,属于混合晶体;红磷和白磷都是分子晶体,红磷是大分子,白磷是小分子,分子量越大,范德华力越大,熔沸点越高;
(4)结合图B可知,图A中编号为②的P原子位于同一坐标轴a,关于坐标轴b对称,且位于坐标轴c的值为1-0.598=0.402,该P原子在晶胞内的坐标为(0.500,-0.090,0.402),该晶胞中第一层含有P原子1+1=2个;第二层含有P原子1+1+1+1=4个;第三层含有P原子1+1=2个,共8个P原子,故答案为:(0.500,-0.090,0.402);8。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在800℃2L密闭容器中,反应2NO+O2![]() 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线。

A点处,v(正)__v(逆),A点正反应速率__B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__。用NO2表示从0~2s内该反应的平均速率v=__。
(3)能使该反应的反应速率增大的是__。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Cu原子中,核外电子占据的最高能层的符号是___________,占据该能层电子的电子云轮廓图形状为__________;Cu2+价层电子的电子排布图为___________。
(2)离子晶体中Cu2O熔点比Cu2S熔点高,其原因是___________________________。
(3)Cu可与N、S,O等元素形成化合物,N、S、O三种元素的第一电离能由大到小的顺序为______________;在Cu的催化作用下,乙醇可被氧化为乙醛,乙醛分子中碳原子的杂化方式是________________。
(4)1mo[Cu(NH3)4]SO4中含有σ键的数目为___________。
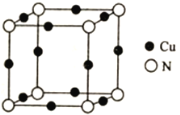
(5)Cu与N所形成的某种晶体的立方晶胞如图所示,其晶胞参数为anm。该晶体的化学式为___________,晶体的密度为___________g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,以下说法不正确的是
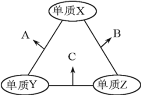
A.A和C不可能发生氧化还原反应
B.X元素位于ⅥA族
C.A不能溶解于B中
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯二氮卓类药物氟马西尼(F)的合成路线如下图所示。请回答下列问题:
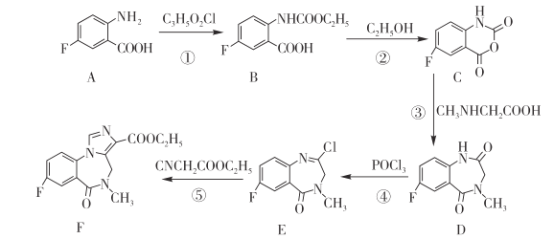
(1)A中官能团有氟原子、_____和________。(均填名称)
(2)C3H5O2Cl的结构式为________。
(3)反应①和②的反应类型相同,其反应类型是___________。
(4)化合物 D的分子式为___________。
(5)反应⑤生成“ 物质 F” 和 HCl,则 E→F的化学反应方程式为________。
(6)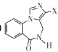 是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
(7)已知氨基酸之间脱水能够形成含肽键的化合物,请设计由甘氨酸(HOOCCH2NH2)和CNCH2COOC2H5制备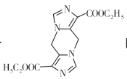 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1.下列有关该溶液的叙述正确的是( )
A. 该溶液一定呈酸性
B. 该溶液中![]() 可能等于
可能等于![]()
![]()
C. 该溶液的pH可能为4也可能为10
D. 该溶液有可能呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯、聚乙烯、乙炔、聚乙炔都能使溴水或高锰酸钾溶液褪色,但与两种试剂发生反应的反应类型是不同的
B.最简单的芳香族化合物是苯,最简单的糖是葡萄糖
C.常温下苯与液溴、铁粉混合反应生成的油状有机物呈红褐色,这是溶有氢氧化铁杂质造成的
D.三氯异氰尿酸(TCCA)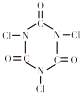 是用于游泳池等公共场合消毒的第三代产品,具有强烈的氯气刺激味,含有效氯在90%以上,结构简式如图所示.据此推测TCCA分子中氯元素显正价
是用于游泳池等公共场合消毒的第三代产品,具有强烈的氯气刺激味,含有效氯在90%以上,结构简式如图所示.据此推测TCCA分子中氯元素显正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.字母A~K代表常见物质,在一定条件下能发生如图所示变化。
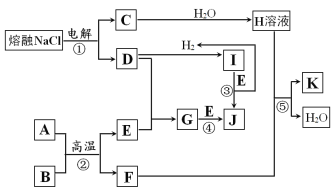
已知:反应②中A为黑色粉末,B为金属单质,且n(A):n(B)=3:2。反应③和④均在水溶液中进行。
(1)写出J的名称:___。
(2)写出反应②的化学方程式:___。
(3)写出反应⑤的离子方程式:___。
II.某研究性学习小组的同学以Fe(NO3)3溶液来探究Fe3+能否氧化Ag为题。他们选用少量的Fe(NO3)3溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
请你判断:以上实验能否得到相关结论。
若你认为能得出结论,请简述理由:___。
若你认为不能得出结论,请在此实验基础上,再继续实验(试剂任选),直至得出相关结论。请设计实验(写出实验操作、现象和结论):___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com