
【题目】对Cl2的叙述正确的是
A. 能用钢瓶贮存B. 与过量的Fe反应只生成FeCl2
C. 与H2混合光照可制取HClD. 与澄清石灰水反应制取漂粉精
科目:高中化学 来源: 题型:
【题目】在一定温度下将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:CO2(g)+H2(g)CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=_____.
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K2=_____,反应![]() CO2(g)+
CO2(g)+![]() H2(g)
H2(g)![]() CO(g)+
CO(g)+![]() H2O(g)的平衡常数K3=_____.
H2O(g)的平衡常数K3=_____.
(3)已知在1 000℃时,该反应的平衡常数K4为1.0,则该反应为_____反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是_____.
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正)_____v(逆)(填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行反应:X2(g)+Y2(g)![]() Z(g)。已知X2、Y2、Z的起始浓度分别为 0.1 mol L-1、0.3mol L-1、0.2mol L-1。在一定条件下,当反应达到平衡时,各物质的量浓度可能是
Z(g)。已知X2、Y2、Z的起始浓度分别为 0.1 mol L-1、0.3mol L-1、0.2mol L-1。在一定条件下,当反应达到平衡时,各物质的量浓度可能是
A. Z为0.3mol L-1 B. Y2为0.4 mol·L-1
C. X2为0.3mol L-1 D. Z为0.4mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是指导我们系统学习化学的重要工具。下表是元素周期表的一部分:
C | N | O | F |
Si | P | S | Cl |
Br | |||
I |
(1)元素周期表中每种元素的具体信息如图例示。从中可以获得氟元素的有关信息有(任意写出1点)_________________________________________。
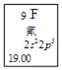
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的______相同。N和P处于同一列,因为它们的________相同,它们都位于元素周期表的第______族。
(3)通过元素周期表,我们可以知道:
①氮元素的最低化合价为___________,其气态氢化物的电子式为_________________。
②原子半径:r(P)_________r(S)(填“>”、“<”或“=”)。
③在上表所列元素的最高价氧化物对应水化物中酸性最强的是_________(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
B.在非标准状况下,1mol任何气体的体积不可能是22.4L
C.标准状况下,22.4L酒精(CH3CH2OH)的分子数为NA
D.一定条件下,2.3g的Na完全与O2反应失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
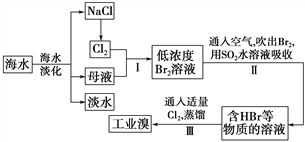
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
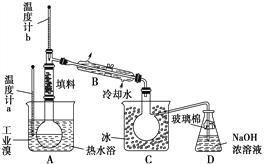
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2NO3-![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe![]() 2Fe2+
2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O![]() Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com