
【题目】![]() 可用作漂白剂和呼吸面具中的供氧剂。
可用作漂白剂和呼吸面具中的供氧剂。
![]() 某学习小组发现:在盛有
某学习小组发现:在盛有![]() 的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量
的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量![]() 粉末,又有气泡产生。请写出加入
粉末,又有气泡产生。请写出加入![]() 反应的化学方程式为_____________。
反应的化学方程式为_____________。
![]() 有强氧化性,
有强氧化性,![]() 具有还原性,有同学猜想
具有还原性,有同学猜想![]() 与
与![]() 能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
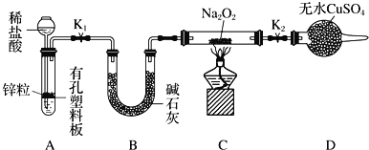
步骤1:按上图组装仪器![]() 图中夹持仪器省略
图中夹持仪器省略![]() ,检查气密性,装入药品。
,检查气密性,装入药品。
步骤2:打开![]() 、
、![]() ,产生的氢气流经装有
,产生的氢气流经装有![]() 的硬质玻璃管,一段时间后,没有任何现象。
的硬质玻璃管,一段时间后,没有任何现象。
步骤3:________________,点燃酒精灯,开始加热,观察到硬质玻璃管内![]() 开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭![]() 。
。
①添加稀盐酸的仪器名称是______________。
②步骤3点燃酒精灯之前必须进行的操作是___________________。
③设置装置D的目的是________________。
④你得到的结论是___________________![]() 若能反应请用化学方程式表示
若能反应请用化学方程式表示![]() 。
。
⑤该实验存在明显的不足之处,应该如何改进___________________。
【答案】2H2O2![]() 2H2O+O2↑ 长颈漏斗 检验氢气纯度 检验有无水生成 氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2
2H2O+O2↑ 长颈漏斗 检验氢气纯度 检验有无水生成 氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2![]() 2NaOH 在装置D后再接一个盛有碱石灰的干燥管并连接一个氢气的尾气处理装置
2NaOH 在装置D后再接一个盛有碱石灰的干燥管并连接一个氢气的尾气处理装置
【解析】
(1)根据题意,过氧化钠与水反应生成了过氧化氢,过氧化氢在二氧化锰做催化剂分解生成水和氧气;
(2)①根据装置图中仪器的构造判断;②氢气是易燃性气体;③D装置中装的是无水硫酸铜,用来检验有无水生成;④过氧化钠变为白色固体,硫酸铜不变蓝色,证明无水生成,说明氢气和过氧化钠反应生成氢氧化钠;⑤干燥管内硫酸铜变蓝色检验水的生成,若空气中水蒸气进入也会变蓝色,另外多余的氢气不能随便排放。
(1)根据题意,过氧化钠与水反应生成了过氧化氢,过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)①根据装置图可知,盛盐酸的仪器为长颈漏斗,故答案为:长颈漏斗;
②氢气是易燃性气体,混有空气,点燃时容易发生爆炸,因此步骤3在点燃C处酒精灯前必须对氢气进行验纯,待氢气纯净后再点燃酒精灯,故答案为:检验氢气纯度;
③装置D中装的是无水硫酸铜,用来检验有无水生成,故答案为:检验有无水生成;
④根据实验现象可知,过氧化钠变为白色固体,硫酸铜不变蓝色,证明无水生成,证明氢气和过氧化钠反应生成了氢氧化钠,反应的化学方程式为,Na2O2+H2 ![]() 2NaOH,故答案为:氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2
2NaOH,故答案为:氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2![]() 2NaOH;
2NaOH;
⑤该实验设计中存在着明显的不足,空气中水蒸气能够进入装置D,使D中无水硫酸铜变蓝色,另外,氢气是易燃气体,不能随便排放,需要尾气处理,应在装置D后连接一个氢气的尾气处理装置,改进方法:在装置D后再接一个干燥管并连接一个氢气的尾气处理装置,故答案为:在装置D后再接一个盛有碱石灰的干燥管并连接一个氢气的尾气处理装置。


科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. CS2为V形的极性分子,形成分子晶体
B. ClO3-的空间构型为平面三角形
C. 氯化硼BCl3的熔点为-107 ℃,氯化硼液态时能导电而固态时不导电
D. SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3 与NaHCO3的性质判断正确的是![]()
![]()
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
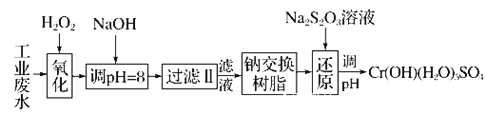
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶多酚具有抗氧化作用和抗衰老、降血脂等一系列很好的药理功能,其结构简式如下图,关于茶多酚的下列说法正确的数目有( )

①1mol茶多酚与浓溴水发生加成反应最多消耗6molBr2
②1mol茶多酚与足量的Na2CO3溶液反应放出4molCO2
③1mol茶多酚与足量的NaOH溶液反应最多消耗10molNaOH
④能发生氧化、取代、加成、缩聚反应
⑤已知茶多酚易溶于水,是因为能与水分子之间形成氢键
⑥能使酸性KMnO4溶液褪色
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图所示实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)回答下列问题:
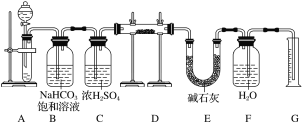
(1)装置A是用来产生CO2气体,则A中液体试剂选用____________,发生反应的离子方程式为___________________。
(2)装置B的作用是_____________________________________________________,装置C的作用是________________________________________________________,装置E中碱石灰的作用是_________________________________________________。
(3)装置D中发生反应的化学方程式为________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com