

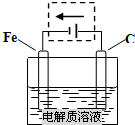
 ,故答案为:
,故答案为: ;
;
| ||
| 0.02mol |
| 0.1L |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
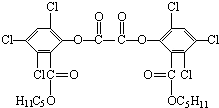 “魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )| A、CPPO属于芳香烃 |
| B、CPPO属于高分子化合物 |
| C、1mol CPPO与氢氧化钠稀溶液反应(假设苯环上卤素不水解),最多消耗6mol NaOH |
| D、1mol CPPO与氢气完全反应,需要氢气10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1 |
| B、该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同 |
| C、降低温度,溶液的c(NH4+)/c(NH3?H3O)减小,PH降低 |
| D、往该溶液中加入足量的NH4Cl固体后,c(NH4+)+c(NH3?H3O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )| A、反应开始到2min,用A表示的反应速率为0.1 mol?Lˉ1?minˉ1 |
| B、反应开始到2min,B的物质的量浓度增加了0.2mol/L |
| C、反应进行到2min时,该反应停止了 |
| D、反应的化学方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、156 mg |
| B、23 4 mg |
| C、31.2 mg |
| D、46.8mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
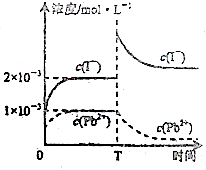 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A、常温下,PbI2的Ksp为2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 |
| C、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
| D、T时刻改变的条件是由于升高温度,PbI2的Ksp增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、可以收集到氯气
| ||
| B、反应后溶液中的Cl-数目为2aNA/87 | ||
C、NA可表示为
| ||
| D、反应后溶液中的H+数目为(bc-2d) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com