
����Ŀ����ϩ����Ҫ���л�����ԭ�ϣ����������Ʊ�ϩ���������ľ��ü�ֵ��������塣�ش��������⣺
��1����֪��I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) H=-238kJ��mol-1
II.2H2(g)+O2(g)=2H2O(g) H=-484kJ��mol-1
����������Ʊ�ϩ��ӦC3H8(g)![]() C3H6(g)+H2(g)��HΪ__��
C3H6(g)+H2(g)��HΪ__��
��2��һ���¶��£�������ܱ������г���1molC3H8����ʼѹǿΪpkPa���������������Ʊ�ϩ��Ӧ��
�����������˵�����������Ʊ�ϩ��Ӧ�ﵽƽ��״̬����__(����ĸ)��
A. �÷�Ӧ���ʱ�(H)���ֲ���
B. ����ƽ��Ħ���������ֲ���
C. �����ܶȱ��ֲ���
D. C3H8�ֽ�������C3H6�����������
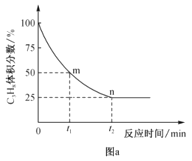
�ڱ��������Ʊ�ϩ��Ӧ�����У�C3H8��������������뷴Ӧʱ��Ĺ�ϵ��ͼa��ʾ�����¶��¸÷�Ӧ��ƽ�ⳣ��Kp=__kPa(�ú���ĸp�Ĵ���ʽ��ʾ��Kp���÷�Ӧ��ϵ���������ʵķ�ѹ��ʾ��ƽ�ⳣ����ƽ���ѹ=��ѹ�����ʵ�������)��
����֪������Ӧ�У�v��=k����p(C3H8)��v��=k����p(C3H6)p(H2)������k����k��Ϊ���ʳ�����ֻ���¶��йأ���ͼa��m�㴦![]() =_��
=_��
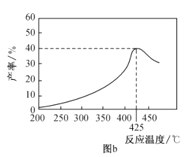
��3��������ͬ��Ӧʱ�䣬�ڲ�ͬ�¶��£���ϩ������ͼb��ʾ����ϩ������425��֮ǰ���¶����߶������ԭ�������__��__��425��֮��ϩ���ʿ��ٽ��͵���Ҫԭ�������__��
���𰸡�+123kJ/mol BD 0.9P 5.4 �¶����߷�Ӧ���ʼӿ� �����¶������ڷ�Ӧ�����ȷ������ ����ʧ������Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ����������
��������
(1)������֪�Ȼ�ѧ����ʽ��˹���ɽ��м��㣻
(2)���������ݻ����䣬�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ���ﵽ��ѧƽ��״̬ʱ���淴Ӧ������ȣ������ʵ�����Ũ�ȵȱ��ֲ��䣬�Լ�����������һЩ��Ҳ���䣬��һ���������仯�����������ˣ��ſ���Ϊ�ж�ƽ��ı�־��
C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ���ﵽ��ѧƽ��״̬ʱ���淴Ӧ������ȣ������ʵ�����Ũ�ȵȱ��ֲ��䣬�Լ�����������һЩ��Ҳ���䣬��һ���������仯�����������ˣ��ſ���Ϊ�ж�ƽ��ı�־��
�ڸ��ݴﵽƽ��ʱ��������������Ϊ25%���г�����ʽ����ƽ��ʱ����������ʵ������������������ѹ���ټ���Kp��
���ȸ��ݵ���Ӧ�ﵽƽ��ʱ��v��=v������k����p(C3H8)= k����p(C3H6)p(H2)������![]() ���ٸ���m�㴦��������������Ϊ50%���г�����ʽ�����ʱ����������ʵ����������ټ����ѹ����������
���ٸ���m�㴦��������������Ϊ50%���г�����ʽ�����ʱ����������ʵ����������ټ����ѹ����������![]() ��
��
(3)�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ�����ͼ��������¶ȶԷ�Ӧ���ʺ�ƽ�⡢�����ȵ�Ӱ����з�����
C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ�����ͼ��������¶ȶԷ�Ӧ���ʺ�ƽ�⡢�����ȵ�Ӱ����з�����
(1)��֪�Ȼ�ѧ����ʽ��I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) H=-238kJ��mol-1��II.2H2(g)+O2(g)=2H2O(g) H=-484kJ��mol-1�����ݸ�˹���ɿ�֪��![]() (I-II)�ɵ�Ŀ�귽��ʽC3H8(g)
(I-II)�ɵ�Ŀ�귽��ʽC3H8(g)![]() C3H6(g)+H2(g)����
C3H6(g)+H2(g)����![]() ���ʴ�Ϊ��+123kJ/mol��
���ʴ�Ϊ��+123kJ/mol��
(2)���������ݻ����䣬�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ��
C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ��
A. �÷�Ӧ���ʱ�(H)Ϊһ��ֵ�����۷�Ӧ�Ƿ�ﵽƽ�⣬ʼ�ձ��ֲ��䣬��÷�Ӧ���ʱ�(H)���ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����A�����ϣ�
B. �����������������䣬���ŷ�Ӧ�Ľ��У��������ʵ�������������ƽ��Ħ���������С��������ƽ��Ħ���������ֲ���ʱ����˵����Ӧ�ﵽƽ��״̬����B���ϣ�
C. �����������������䣬�������ݻ����䣬�������ܶ�Ϊһ��ֵ��ʼ�ձ��ֲ��䣬�������ܶȱ��ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����C�����ϣ�
D. C3H8�ķֽ�����Ϊ����Ӧ���ʣ�C3H6����������Ϊ�淴Ӧ���ʣ�������ȣ���C3H8�ķֽ�������C3H8������������ȣ�˵�����淴Ӧ������ȣ���˵����Ӧ�ﵽƽ��״̬����D���ϣ��ʴ�Ϊ��BD��
����ͼ��֪�ﵽƽ��ʱ��������������Ϊ25%��������ת����Ϊxmol�����г�����ʽ����λΪ��mol����
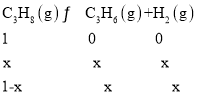 ���������������Ϊ
���������������Ϊ![]() �����x=0.6����ƽ��ʱ���������ʵ���Ϊ1.6mol�����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã�ƽ��ʱ���������ѹǿΪ1.6pkPa����ϩ�����ʵ������������������ʵ���������Ϊ
�����x=0.6����ƽ��ʱ���������ʵ���Ϊ1.6mol�����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã�ƽ��ʱ���������ѹǿΪ1.6pkPa����ϩ�����ʵ������������������ʵ���������Ϊ![]() ����p(C3H8)=
����p(C3H8)=![]() ��p(C3H6)=p(H2)=
��p(C3H6)=p(H2)=![]() ����
����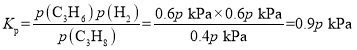 ��
��
�ʴ�Ϊ��0.9P��
�۵���Ӧ�ﵽƽ��ʱ��v��=v������k����p(C3H8)= k����p(C3H6)p(H2)����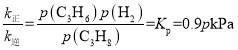 ��m�㴦��������������Ϊ50%��������ת����Ϊxmol�����г�����ʽ����λΪ��mol����
��m�㴦��������������Ϊ50%��������ת����Ϊxmol�����г�����ʽ����λΪ��mol����
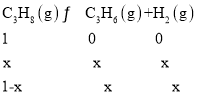 ���������������Ϊ
���������������Ϊ![]() �����x=
�����x=![]() �����ʱ���������ʵ���Ϊ
�����ʱ���������ʵ���Ϊ![]() �����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã���ʱ�������ѹǿΪ
�����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã���ʱ�������ѹǿΪ![]() ����ϩ�����ʵ������������������ʵ���������Ϊ
����ϩ�����ʵ������������������ʵ���������Ϊ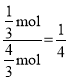 ����p(C3H8)=
����p(C3H8)=![]() ��p(C3H6)=p(H2)=
��p(C3H6)=p(H2)=![]() ����
����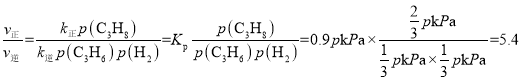 ���ʴ�Ϊ��5.4��
���ʴ�Ϊ��5.4��
(3)�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ��������ͬ��Ӧʱ�䣬425��֮ǰ���¶�Խ�߷�Ӧ����Խ�죬�¶�Խ�ߣ�ƽ�������ƶ��̶�Խ��ϩ����Խ��425��֮��ϩ���ʿ��ٽ��ͣ��������¶ȹ��ߣ����´���ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ����������ʴ�Ϊ���¶����߷�Ӧ���ʼӿ죻�����¶������ڷ�Ӧ�����ȷ�����У�����ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ���������
C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ��������ͬ��Ӧʱ�䣬425��֮ǰ���¶�Խ�߷�Ӧ����Խ�죬�¶�Խ�ߣ�ƽ�������ƶ��̶�Խ��ϩ����Խ��425��֮��ϩ���ʿ��ٽ��ͣ��������¶ȹ��ߣ����´���ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ����������ʴ�Ϊ���¶����߷�Ӧ���ʼӿ죻�����¶������ڷ�Ӧ�����ȷ�����У�����ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ���������


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
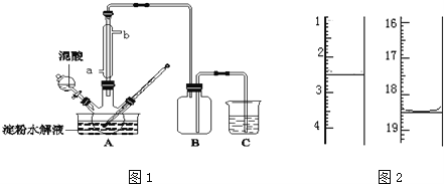
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�����������������ǻ�����ѧ�о����ȵ���⡣
I.������ԭ����H2��ԭNO�����ķ�ӦΪ��2NO(g)+2H2(g)![]() N2(g)+2H2O(g)��
N2(g)+2H2O(g)��
��1����֪���ֻ�ѧ���ļ����������£�

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ��H=___kJ��mol-1��
N2(g)+2H2O(g) ��H=___kJ��mol-1��
��2��2NO(g)+2H2(g)![]() N2(g)+2H2O(g)�ķ�Ӧ���ʱ���ʽΪv=kc2(NO)��c(H2)(k�����ʳ�����ֻ���¶��йأ�����ѧ�о�����������Ӧ���������У�
N2(g)+2H2O(g)�ķ�Ӧ���ʱ���ʽΪv=kc2(NO)��c(H2)(k�����ʳ�����ֻ���¶��йأ�����ѧ�о�����������Ӧ���������У�
��Ӧ1��2NO(g)+H2(g)![]() N2(g)+H2O2(g)��
N2(g)+H2O2(g)��
��Ӧ2��H2O2(g)+H2(g)![]() 2H2O(g)��
2H2O(g)��
�ܷ�Ӧ�����ɷ�Ӧ������һ���������ɴ���֪����������Ӧ�У���ܽϴ���Ƿ�Ӧ___���l����2������c(NO)���ܷ�Ӧ���ʵ�Ӱ��̶�___c(H2)������ڡ���С�ڡ����ڡ�����
��.NH3��ԭ�����ں����ܱ������г���NH3��NO2����һ���¶��·�����Ӧ��8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)��
7N2(g)+12H2O(g)��
��3�����б����÷�Ӧ�ﵽƽ��״̬����___������ĸ����
A����������ܶȱ��ֲ��� B��NO2��N2����������֮��Ϊ6��7
C�����������c(N2)=c(NO2) D���������ѹǿ���ֲ���
III.CO��ԭ�������ø�Ч������������β���е�NO��CO��������Ӧ��2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H����2L�����ܱ������г���2molCO��2molNO�����NO��ת�������¶ȡ�ʱ��Ļ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g) ��H����2L�����ܱ������г���2molCO��2molNO�����NO��ת�������¶ȡ�ʱ��Ļ�ϵ��ͼ��ʾ��
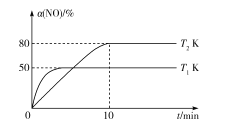
��4������˵����ȷ����___������ĸ����
A��ͼ���У�T1>T2
B��������Ӧ�ڸ��������Է�����
C��10minʱ��T2K�������淴Ӧ�������
D������NO��Ũ�ȣ���Ӧ���ת��������
��5��T2K�¶��£�0-10min����CO��ʾ��ƽ����Ӧ����v(CO)=___mol/L-1��min-1��T1K�¶��£�������Ӧ��ƽ�ⳣ��K=___L��mol-1��
��6��T1K�¶��£���ƽ�����������ټ���2molN2��2molNO����ƽ��___��������ƶ����������ƶ������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ǽ���������S���ǵ���ɫ�����ĩ��������ˮ��Ϊ����֤��Ԫ�صķǽ����Ա���Ԫ�صķǽ�����ǿ��ij��ѧʵ��С�����������ʵ�飬��ش��������⣺
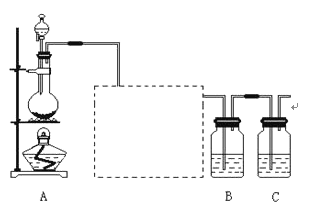
��1��װ��A�ķ�Һ©����ʢװ���Լ���____����ƿ�еĻ�ѧ��Ӧ����ʽ___��
��2���������߿��ڵ�ʵ��װ��ͼ______�������Լ�Ϊ______��װ�õ�����______��
��3��װ��B��ʢ�ŵ��Լ���______ ��ѡ�����������Լ��Ĵ��룩��ʵ������Ϊ______���÷�Ӧ�����ӷ���ʽ��______���÷�Ӧ�������ֻ�����Ӧ�����е�______��Ӧ��
A��Na2S��Һ B��Na2SO3��Һ C��Na2SO4��Һ
��4����֪��������ȴ������ȶ����ڸ��������������ǿ����S2����Cl���ױ���������HCl��H2S�ȶ�����ͭ�������Ӧ��������Ũ���ᷴӦ�����������������������Ȼ������������������������������ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ�Ӱ뾶С����ԭ�ӣ���˵���ȱ���ǽ�����ǿ����______��
A��ȫ�� B���ڢۢܢޢ�C���٢ڢܢݢ�D�� �� ������
��5��װ��C��ʢ���ռ���Һ��Ŀ�������շ�Ӧ��ʣ������壬��ֹ��Ⱦ������д����Ӧ�����ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A�����ʱ������Ӧ��Ni(OH)2 ��e�� + OH- = NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol��L��1��NaOH��Һ�ζ�20.00mLŨ��Ϊ0.10mol��L��1��HX��Һ���õζ���������ͼ(������Һ����仯)������˵����ȷ����
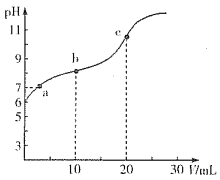
A. ������K(HX)��1��10��12
B. a����ʾ����Һ�У�c(Na+)>c(X��)>c(OH��)=c(H+)
C. c����ʾ����Һ�У�c(Na+)+c(HX)+c(X��)=0.10mol��L��1
D. ��ͬ�����£�X����ˮ����������HX�ĵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������һ��ʹ�ù������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߣ������ں��캽�ա���ͼ1��ʾװ���У���ϡ���������������Ե缫���ڵ缫�Ϸֱ�ͨ�����Ϳ��������й��������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2��(O2��4e��===2O2��)��
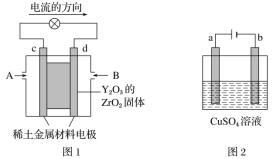
(1)c�缫������Ϊ__________��������������������������d�缫�ϵĵ缫��ӦʽΪ_________
(2)��ͼ2��ʾ�ö��Ե缫���100mL0.5mol��L��1����ͭ��Һ��a�缫�ϵĵ缫��ӦʽΪ_______��b�缫�ϵĵ缫��ӦʽΪ ____________________,��a�缫����56mL(��״��)���壬���·��ת�Ƶĵ���Ϊ__________mol��������Һ��pH��________(��������Һ����仯)����Ҫʹ�������Һ�ָ������ǰ��״̬���ɼ���________(����ĸ)��
a��CuO b��Cu(OH)2 c��Cu d��Cu2(OH)2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�����������ˮ�����й㷺�漰���ʼ��仯���
��.ú�ƵõĻ���ԭ���к����ʻ���(O===C===S)�������ʿ�ת��ΪH2S����Ҫ��Ӧ���£���ˮ�ⷴӦ��COS(g)��H2O(g)![]() H2S(g)��CO2(g)����H1����94 kJ��mol��1������ⷴӦ��COS(g)��H2(g)
H2S(g)��CO2(g)����H1����94 kJ��mol��1������ⷴӦ��COS(g)��H2(g)![]() H2S(g)��CO(g)����H2����54 kJ��mol��1��
H2S(g)��CO(g)����H2����54 kJ��mol��1��
��1�������CO(g)��H2O(g)����H2(g)��CO2(g)�ķ�Ӧ�Ȧ�H��______��
��2���ڶ��¶��ݵ��ܱ������н��з�Ӧ�٣�������ʵ˵����Ӧ�ٴﵽƽ��״̬����_____(����ĸ)��
A��������ѹǿ���ٸı�
B�����������ܶȲ��ٸı�
C����ѧƽ�ⳣ�����ٸı�
D������1 mol H��O����ͬʱ����1 mol H��S��
��3����Ӧ�ڵ������淴Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ��ʾ����T1 ��ʱ�����ݻ�Ϊ5 L���ܱ������м���2 mol COS(g)��1 mol H2(g)����ַ�Ӧ��COS��ƽ��ת����Ϊ______��
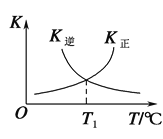
��.���ݻ�Ϊ2 L�ĺ����ܱ������У�����0.5 mol H2S(g)��������Ӧ��2H2S(g) ![]() 2H2(g)��S2(g)���ڲ�ͬ�¶Ⱥ�ѹǿ�½���ʵ�飬�����ͼ��ʾ��
2H2(g)��S2(g)���ڲ�ͬ�¶Ⱥ�ѹǿ�½���ʵ�飬�����ͼ��ʾ��
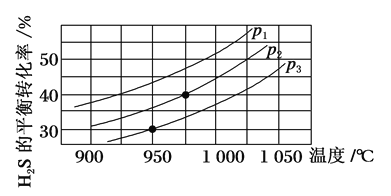
��4��ͼ��ѹǿp1��p2��p3�ɴ�С��˳����______��
��5����950 �棬ѹǿΪp3ʱ����Ӧ��30 min�ﵽƽ�⣬��ƽ����Ӧ����v(H2)��_______��
��6����p2��6 MPa���¶�Ϊ975 ��ʱ�������÷�Ӧ��ƽ�ⳣ��KcΪ_____(����2λ��Ч����)���������෴Ӧ����ij���(B)��ƽ���ѹ(pB)�������ʵ���Ũ��(cB)Ҳ���Ա�ʾƽ�ⳣ��(����Kp)��pB��p����B�����ʵ�����������������¸÷�Ӧ��ƽ�ⳣ��Kp��___MPa��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��2L���ܱ������У�������Ӧ3A(g)��2B(g)![]() 4C(s)��2D(g)������4molA��2molB��2min��ﵽƽ�⣬�������1.6mol C��������˵����ȷ���ǣ�
4C(s)��2D(g)������4molA��2molB��2min��ﵽƽ�⣬�������1.6mol C��������˵����ȷ���ǣ�
A.�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K��![]()
B.��ʱ��B��ƽ��ת������40%
C.�������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D.����ƽ����ϵ���߲���D�����ʱ����Ӧ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com