
【题目】在化工生产、污水处理中广泛涉及硫单质及其化合物。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=______。
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是_____(填字母)。
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
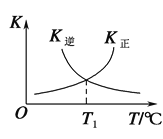
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1 ℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为______。
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g) ![]() 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
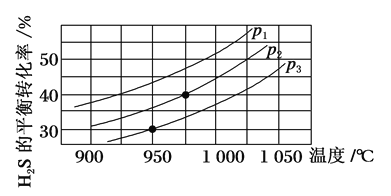
(4)图中压强p1、p2、p3由大到小的顺序是______。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=_______。
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为_____(保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp=___MPa。
【答案】-40kJ·mol-1 D 33.3% p3>p2>p1 0.0025mol·(L·min)-1 0.022mol·L-1 ![]()
【解析】
(1)根据盖斯定律,由反应①-反应②得CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=ΔH1-ΔH2=-94 kJ·mol-1-(-54 kJ·mol-1)=-40 kJ·mol-1;
H2(g)+CO2(g) ΔH=ΔH1-ΔH2=-94 kJ·mol-1-(-54 kJ·mol-1)=-40 kJ·mol-1;
(2)A. 反应①为反应前后气体分子数不变的反应,容器容积不变,压强始终保持不变,根据压强不能判断反应是否达到平衡状态,故A错误;
B. 该反应的反应物和生成物均为气体,且容器容积不变,则混合气体的密度始终保持不变,据此不能判断反应是否达到平衡状态,故B错误;
C. 化学平衡常数只受温度影响,由于温度不变,不能由此判断反应是否达到平衡状态,故C错误;
D. 生成1 mol H—O键,同时生成1 mol H—S键,说明反应物的消耗速率等于生成物的消耗速率,也即正反应速率与逆反应速率相等,说明反应达到平衡状态,故D正确;
(3)设反应达到平衡时,转化的COS的物质的量为x mol,根据反应方程式COS(g)+H2(g)![]() H2S(g)+CO(g)可知平衡时COS(g)、H2(g)、H2S(g)、CO(g)的物质的量分别为(2-x) mol、(1-x) mol、x mol、x mol,容器的体积为5L,根据T1 ℃时有K正=K逆得
H2S(g)+CO(g)可知平衡时COS(g)、H2(g)、H2S(g)、CO(g)的物质的量分别为(2-x) mol、(1-x) mol、x mol、x mol,容器的体积为5L,根据T1 ℃时有K正=K逆得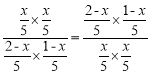 ,解得x=
,解得x=![]() mol,则COS的平衡转化率为
mol,则COS的平衡转化率为![]() ×100%=33.3%;
×100%=33.3%;
(4)该反应为气体分子数增大的反应,温度一定时,压强越小,H2S的平衡转化率越高,故压强p3>p2>p1;
(5)根据题图2可看出在950 ℃,压强为p3时,H2S的平衡转化率为30%,即反应的H2S的物质的量为0.5 mol×30%=0.15 mol,由于化学方程式中H2S和H2的化学计量数相同,则v(H2)=v(H2S)= =0.002 5 mol·(L·min)-1;
=0.002 5 mol·(L·min)-1;
(6)根据题图2可知压强为p2、温度为975 ℃时,H2S的平衡转化率为40%,即分解的H2S为0.5 mol×40%=0.2 mol,根据方程式2H2S(g)![]()
![]() 2H2(g)+S2(g)可知生成的n(S2)=0.1mol,n(H2)=0.2mol,剩余的n(H2S)=0.3mol,容器的体积为2L,所以平衡时H2S(g)、H2(g)、S2(g)的物质的量浓度分别为0.15 mol·L-1、0.10 mol·L-1和0.05 mol·L-1,则Kc=
2H2(g)+S2(g)可知生成的n(S2)=0.1mol,n(H2)=0.2mol,剩余的n(H2S)=0.3mol,容器的体积为2L,所以平衡时H2S(g)、H2(g)、S2(g)的物质的量浓度分别为0.15 mol·L-1、0.10 mol·L-1和0.05 mol·L-1,则Kc=![]() mol·L-1≈0.022 mol·L-1。平衡时H2S(g)、H2(g)、S2(g)的物质的量分别为0.3 mol、0.2 mol和0.1 mol,即对应的平衡分压分别为
mol·L-1≈0.022 mol·L-1。平衡时H2S(g)、H2(g)、S2(g)的物质的量分别为0.3 mol、0.2 mol和0.1 mol,即对应的平衡分压分别为![]() p2、
p2、![]() p2、
p2、![]() p2,则此时对应的Kp=
p2,则此时对应的Kp=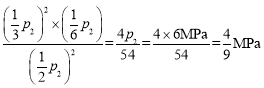 。
。


科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水剧烈反应,并产生能使品红褪色的气体。下列说法错误的是

A. S2Cl2的分子中的两个S原子均是sp3杂化
B. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
C. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O = SO2↑+3S↓+4HCl
D. S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题:
(1)已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) H=-238kJ·mol-1
II.2H2(g)+O2(g)=2H2O(g) H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)![]() C3H6(g)+H2(g)的H为__。
C3H6(g)+H2(g)的H为__。
(2)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生丙烷脱氢制丙烯反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是__(填字母)。
A. 该反应的焓变(H)保持不变
B. 气体平均摩尔质量保持不变
C. 气体密度保持不变
D. C3H8分解速率与C3H6消耗速率相等
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=__kPa(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
③已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)p(H2),其中k正、k逆为速率常数,只与温度有关,则图a中m点处![]() =_。
=_。
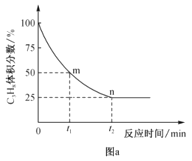
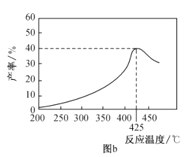
(3)保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是__、__;425℃之后,丙烯产率快速降低的主要原因可能是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
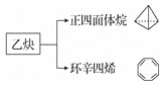
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2CO3 和 H2C2O4 都是二元弱酸,不同 pH 环境下它们不同形态的粒子的组成百分率如图所示:

下列说法正确的是
A. 在 pH 为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-)
B. 反应 HCO3-+H2O![]() H2CO3+OH-的平衡常数为 10-7.63
H2CO3+OH-的平衡常数为 10-7.63
C. 0.1 molL-1 NaHC2O4 溶液中 c(HC2O4-)+2c(C2O42-)+c(H2C2O4) =0.1 molL-1
D. 往 Na2CO3 溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国马丁·卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖。他们模拟出了1, 6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示。下列说法正确的是 ( )
![]()
A. 该有机物属于芳香烃,与苯互为同系物
B. 该有机物的分子式为C18H18
C. 1 mol该有机物在常温下最多能与9 mol Br2发生加成反应
D. 该有机物可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
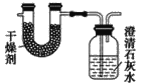
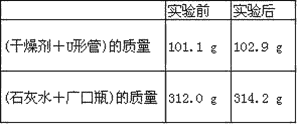
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为_____________g。
(2)生成的水中氢元素的质量为_______g。
(3)生成的二氧化碳中碳元素的质量为_______ g。
(4)该燃料中碳元素与氢元素的质量比为_______。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_______,结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
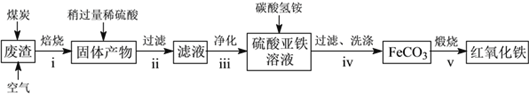
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com