
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)通过下列反应合成甲醇。下列说法正确的是
反应①:CO2(g) + H2(g)![]() CO(g) + H2O(g) △H1=41 kJ·mol–1
CO(g) + H2O(g) △H1=41 kJ·mol–1
反应②:CO(g) + 2H2(g)![]() CH3OH(g) △H2=–99 kJ·mol–1
CH3OH(g) △H2=–99 kJ·mol–1
反应③:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H3
CH3OH(g) + H2O(g) △H3
A. 反应①为放热反应 B. 增大反应①的压强,H2转化率提高
C. 反应②使用催化剂,△H2不变 D. △H3=-58 kJ·mol–1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是( )
A. 铁红——Fe3O4 B. 小苏打——Na2SO4 C. 石英——SiO2 D. 生石灰——Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4 L CH2Cl2中含有的CH2Cl2分子数为NA
B. 60 g SiO2中含Si-O键数目为2NA
C. 足量浓硫酸与65 g锌发生反应,转移的电子数为2NA
D. pH=1的H2SO4溶液中含有的H+ 数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开
B. 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种
C. 二糖、淀粉、纤维素水解的最终产物都是葡萄糖
D. 芥子醇结构简式是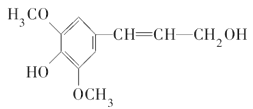 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。

(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。
① B原子的杂化方式为________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:________。
(4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。
① 与氮原子直接连接的硼原子构成的几何形状为________。硼原子和氮原子所连接的最小环为________元环。
② 晶胞有两个基本要素:
原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。
晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com