
【题目】下列有关金属的工业制法中,正确的是
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制铁:以铁矿石为原料,CO还原得铁
C. 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
D. 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题:
(1)做实验时皮肤上不小心粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4- + C2O42- + H+ → CO2↑+ Mn2+ + ![]()
①该反应的氧化剂是_____右边方框内的产物是_____
②完成并配平该离子方程式 __________________电子转移总数是_____ e-
(2)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。单质A能与某气态单质化合生成化合物B。
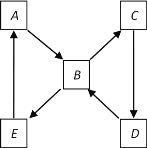
若化合物B是造成酸雨的主要污染物,化合物D是组成单质A元素的最高价氧化物对应水化物,则单质A是_________(物质名称),将化合物B通入溴水中观察到的现象是_________ ,该现象说明化合物B具有_______ 性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A. Mg在CO2中的燃烧是置换反应
B. 将Mg(OH)2沉淀转化为MgCl2,是镁原子失电子转化为Mg2+
C. 电解得到镁的过程可以写出离子反应方程式,但不是氧化还原反应
D. Mg在CO2中燃烧的反应中,CO2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.③④B.①②③④C.①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.胶体都有丁达尔现象B.向FeCl3溶液中加入KSCN,最终会看到血红色沉淀
C.氢氧化铁胶体可以透过滤纸D.向硫酸铜溶液中加入一小块金属钠,最终会看到蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的核外电子排布式为___________,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________,与其为等电子体的分子是___________
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
(3)单质铜及镍都是由____键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是______________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为____________。
②若合金的密度为d g·cm–3,晶胞参数a=__________nm。
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3和NH3键角不同,其中键角较大的是____________,其原因是_______________________。且NF3不易与Cu2+形成配离子,其原因是:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
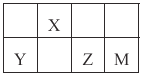
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com