
【题目】沼气是一种能源,它的主要成分是CH4 . 0.5molCH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ?mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ?mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣890 kJ?mol﹣1
D.![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═ ![]() CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】天然气根据成分不同分为贫气和富气,贫气中甲烷的含量较多,富气中乙烷、丙烷、丁烷的含量相对高一些.若要将它们液化,下列说法正确的是( )
A.贫气易液化
B.富气易液化
C.二者液化条件相同
D.加压降温均有利于两者液化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA
B. 25℃、1.01×105Pa条件下,11.2L丙炔分子中所含碳氢键数为2NA
C. 常温下,2.7g铝分别与足量的盐酸或烧碱溶液反应时,失去的电子数都为0.3NA
D. 1molNO2与足量H20反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A.乙醇在空气中燃烧
B.光照条件下,甲烷与氯气发生反应
C.乙烯使溴的四氯化碳溶液褪色
D.在镍做催化剂的条件下,苯与氢气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A、B反应生成C和D,在2L的密闭容器中进行,起始时加入了4molA和2molB,经过一段时间达到反应限度,测得C的浓度为1mol/L,D的平均反应速率为0.2 mol·L-·min-,A与B都反应了50%,且D与A的化学计量数相同,请回答下列问题:
(1)达到反应限度这段时间内A的反应速率为______________。
(2)写出该反应的化学方程式:________________________________。
(3)达到化学反应限度所用的时间为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,甲、乙均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
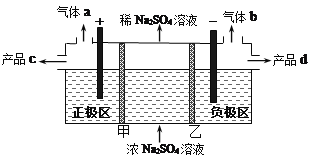
A. 甲为阳离子交换膜,通电后中间隔室的Na+离子向正极迁移
B. 通电后,同温同压下得到的气体a与气体b的体积比约为2:1
C. 通电后,得到的产品c是NaOH,产品d是H2SO4
D. 负极区发生的电极反应为2H2O +2e-=2OH-+H2↑,负极区溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
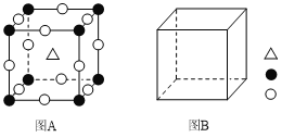
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
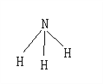
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com