
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA
B. 25℃、1.01×105Pa条件下,11.2L丙炔分子中所含碳氢键数为2NA
C. 常温下,2.7g铝分别与足量的盐酸或烧碱溶液反应时,失去的电子数都为0.3NA
D. 1molNO2与足量H20反应,转移的电子数为NA
【答案】C
【解析】A. 在O2 参与的反应中,1molO2 作氧化剂时得到的电子数不一定是4NA,如钠在氧气中燃烧生成过氧化钠时,1molO2 得到的电子数只有2NA,A不正确;B. 25℃、1.01×105Pa条件下,气体摩尔体积大于22.4L/mol,所以11.2L丙炔的物质的量小于0.5mol,分子中所含碳氢键数小于2NA,B不正确;C. 2.7g铝的物质的量为0.1mol,与足量的盐酸或烧碱溶液反应时,铝都转化为+3价铝的化合物,所以失去的电子数都为0.3NA,C正确;D. 3NO2+H2O=2HNO3+ NO,该反应中电子转移数为2e-,所以1molNO2与足量H2O反应,转移的电子数为![]() NA,D不正确。本题选C。
NA,D不正确。本题选C。


科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
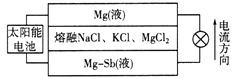
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 标准状况下,18gH218O所含质子数为10NA
B. 1molOH-所含有的电子数为9NA
C. Na2O2与H2O的反应中,每生成0.1molO2,转移电子数目为0.2NA
D. 1molMgCl2中含有的离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盛有NO和NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.
(1)写出有关反应的化学方程式.
(2)原混合气体中NO和NO2的体积比是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.含有离子键的化合物一定是离子化合物
B.含有共价键的化合物一定是共价化合物
C.非极性键也可能存在于离子化合物中
D.用化学键的观点解释化学反应的本质:旧键的断裂和新键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是周期表前四周期的元素,原子序數依次增大。A的基态原子2p能级上有2个单电子;C是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一;D与F不同周期,但最外能层电子数相等。
(1)写出基态C原子的电子排布式: ____________。
(2)A、B、C三种元素第一电离能最大的是____________。(用元素符号表示),其原因是____________。
(3)B、C两元素形成的化合物B2C的分子空间构型为____________。与B2C互为等电子体的粒子的化学式为____________。(填一种)。
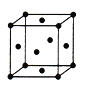
(4)D、E形成的一种离子化合物,在晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为ncm,阿伏加德罗常数为NA,求晶胞的密度ρ=_______g/cm3(用含n、NA的计算式表示)。
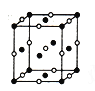
(5)由F原子形成的晶胞结构如图,F原子的半径为r,列式表示F原子在晶胞中的空间利用率:__________________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4 . 0.5molCH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ?mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ?mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣890 kJ?mol﹣1
D.![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═ ![]() CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
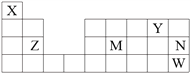
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
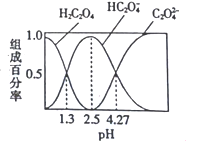
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com