

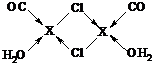
 ;
;

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O |
| B、铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ |
| C、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| D、硫酸铜溶液与氢氧化钡溶液混合 Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
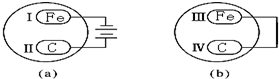
查看答案和解析>>
科目:高中化学 来源: 题型:
| 颜色 | 状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色 | 固体 | 较软 | 2.70g/cm3 | 660.4℃ | 良好 | 良好 | 良好 |
| 实验步骤 | 实验现象 | 结论 |
| 第一步:取一块合金,加入足量的 |
该合金是由M、Fe和Ag组成. | |
| 第二步:取上述未反应完全的固体,加入足量的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解水时,加少量硫酸可使电解速率加快 |
| B、H2O2中加入少量MnO2,即可迅速放出气体 |
| C、在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 |
| D、用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com