
【题目】短周期元素W、X、Y、Z的原子序数依次增大,Y的原子半径是短周期主族元素中最大的,元素W的最外层电子数是次外层的2.5倍,元素X的最外层电子数是电子层数的3倍,元素Z的单质,通常为黄绿色气体,与Y的最高价氧化物的水化物反应的产物可作漂白剂和消毒剂。
(1)元素W、X、Y、Z的符号分别是______,______,______,______。
(2)实验中制备Z单质的反应方程式为 ________________________。
(3)Z单质与X的氢化物发生反应的化学方程式为 __________________ 。若将干燥的有色布条放入Z的单质中,观察到的现象是 ___________________,原因是__________。
(4)Z单质与Y的最高价氧化物的水化物反应的化学方程式是_______,该反应中2mol Z完全反应时转移电子的数目_______ NA。
(5)实验中制备W的氢化物的反应方程式为 _________________。
【答案】N O Na Cl ![]()
![]() 有色布条未褪色 干燥的氯气没有漂白性
有色布条未褪色 干燥的氯气没有漂白性 ![]() 2
2 ![]()
【解析】
(1)Y的原子半径是短周期主族元素中最大的,Y为Na元素;元素W的最外层电子数是次外层的2.5倍,W为N元素;X最外层电子数是电子层数的3倍,X为O元素;元素Z的单质,通常为黄绿色气体,与Y的最高价氧化物的水化物反应的产物可作漂白剂和消毒剂,Z为Cl元素;
(2)实验室制Cl2的原理为:![]() ;
;
(3)X的氢化物为H2O,则Cl2与H2O反应的化学方程式为:![]() ,因干燥的氯气没有漂白性,所以干燥的有色布条在氯气中不褪色;
,因干燥的氯气没有漂白性,所以干燥的有色布条在氯气中不褪色;
(4)Y的最高价氧化物的水化物为NaOH,则Z单质与Y的最高价氧化物的水化物发生反应的化学方程式为![]() ;当反应1molCl2时,转移1mol电子,该反应中2mol Cl2完全反应时转移2NA个电子;
;当反应1molCl2时,转移1mol电子,该反应中2mol Cl2完全反应时转移2NA个电子;
(5)W的氢化物为NH3,实验室制备氨气的化学方程式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的原子序数是其最外层电子数的三倍,下列说法正确的是( )
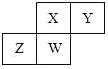
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Y、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:3A(g)+B(g)![]() 2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为________,此温度下的平衡常数K=________。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向________(填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比![]() 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率________;若将C分离出来,化学平衡常数________。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是

A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
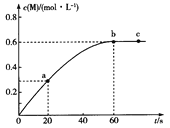
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
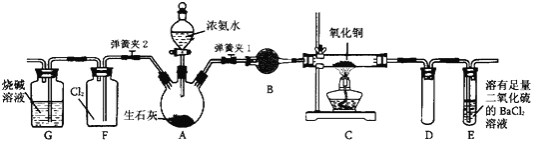
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明崇祯年间《徐光启手迹》记载了《造强水法》 :“绿钒(FeSO47H2O)五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,次用铁作锅,…… 锅下起火,取气冷定,开坛则药化为水……。用水入五金皆成水,惟黄金不化水中,加盐则化。……强水用过无力……”。下列有关解释错误的是
A.“将矾炒去,约折五分之一”后生成FeSO44H2O
B.该方法所造“强水”为硝酸
C.“惟黄金不化水中,加盐则化”的原因是加人 NaCl溶液后氧化性增强
D.“强水用过无力”的原因是“强水”用过以后,生成了硝酸盐溶液,其氧化性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com