
【题目】利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物)。请填写下列空白:

(1)检验乙醛的试剂是_________;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为____________;
(3)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝?_____________,原因是_________;该实验中“鼓气速度”这一变量你认为可用______来估量;
(4)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是_______。以下实验需要水浴加热的是_________;(选填编号)
a.卤代烃水解 b.银镜反应 c. 乙酸丁酯 d.苯的硝化反应
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应)。该同学为解释上述现象,提出两种猜想:① 溴水将乙醛氧化为乙酸;② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
【答案】ac 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 先点燃酒精灯加热铜丝 先产生氧化铜使乙醇反应更充分 单位时间内甲中的气泡量 使生成乙醇蒸气的速率加快且较均匀 bd 用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确
2CH3CHO+2H2O 先点燃酒精灯加热铜丝 先产生氧化铜使乙醇反应更充分 单位时间内甲中的气泡量 使生成乙醇蒸气的速率加快且较均匀 bd 用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确
【解析】
(1)含有醛基的物质能够发生银镜反应,能够与新制的氢氧化铜反应;
(2)乙醇催化氧化生成乙醛和水;铜与氧气反应生成氧化铜,氧化铜与乙醇反应生成乙醛;
(3)先点燃酒精灯加热铜丝生成氧化铜,能够使乙醇更充分的反应;该实验中“鼓气速度”这一变量可用单位时间内甲中的气泡量来估测;
(4)水浴加热可以让乙醇在一定的温度下成为蒸气,从而加快反应的速率;依据反应条件判断解答;
(5)若是乙醛被氧化,则有乙酸和溴化氢生成,溶液呈强酸性;若是发生加成反应,则生成饱和含溴有机物,溶液仍为中性,故可利用酸碱指示剂来确定哪种猜想是正确的;
(1)乙醛含有醛基,能够发生银镜反应,与新制的氢氧化铜反应生成砖红色沉淀,所以通常用银氨溶液、新制的氢氧化铜检验;
(2)乙醇催化氧化生成乙醛和水,化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)铜与氧气反应生成氧化铜,氧化铜与乙醇反应生成乙醛,先点燃酒精灯加热铜丝生成氧化铜,能够使乙醇更充分的反应;该实验中“鼓气速度”这一变量可用单位时间内甲中的气泡量来估测;
(4)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀;水浴加热温度为小于100度,
a.卤代烃水解反应条件为加热,不需要水浴加热,故a不符合题意;
b.银镜反应需要的温度不超过100℃,故可以用水浴加热,故b符合题意;
c.制取乙酸丁酯需要的温度较高,需要用酒精灯直接加热,不能用水浴加热,故c不符合题意;
d.苯和浓硝酸、浓硫酸在50℃~60℃发生硝化反应生成硝基苯和水,应用水浴加热,故d符合题意;
故答案选bd;
(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性,乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确,反之猜想②正确。


科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
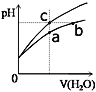
A.a、b、c三点溶液的离子浓度之和a>b>c
B.b点溶液中c(H+)+c(NH3·H2O)= c(OH-)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc
D.a、b、c三点溶液中水的电离程度 a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
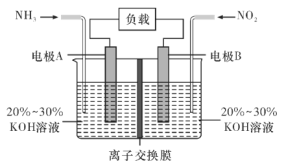
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
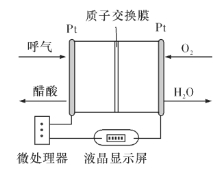
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:______________________________,负极反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
A.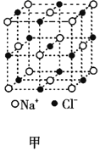 在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B.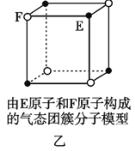 该气态团簇分子(图乙)的分子式为EF或FE
该气态团簇分子(图乙)的分子式为EF或FE
C.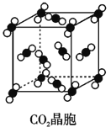 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.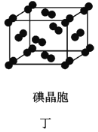 在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称为2,6-二甲基-5-乙基庚烷
的名称为2,6-二甲基-5-乙基庚烷
B.丙氨酸CH3CH(NH2)COOH和苯丙氨酸C6H5-CH2-CH(NH2)COOH 脱水,最多可生成3种二肽
C.化合物 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A装置常用于实验室制备气体
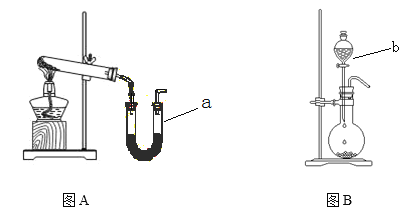
(1)写出实验室用该装置制备O2化学方程式 __________________________________。
(2)若利用该装置制备干燥NH3,试管中放置药品是_______________(填化学式);仪器 a中放置药品名称是________ 。
(3)图B装置实验室可用于制备常见的有机气体是_______。仪器b名称是_________。有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因 。______________________________________________________________
(4)学生甲按图所示探究氨催化氧化
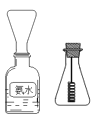
①用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气 ,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色。下列叙述正确的是_________
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
②学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确。_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com