
【题目】某实验小组对H2O2的分解做了如下探究:下表是该实验小组研究影响H2O2分解速率的因素时
记录的一组数据:用10mL H2O2制取150mL(标准状况下)O2所需的时间(s)
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂加热 | 360 | 480 | t | 720 |
MnO2催化剂加热 | 10 | 25 | 60 | 120 |
(1)①该实验小组在设计方案时,考虑了浓度、、等因素对H2O2分解速率的影响.
上述因素对H2O2分解速率的影响分别是:
②推测t(s)的范围为 .
(2)下列有关催化剂的说法中正确的是(填序号)
A.催化剂不参与反应,反应前后催化剂的性质和质量都不变
B.催化剂在化学反应前后化学性质和质量都不变
C.催化剂能使不起反应的物质发生反应
D.催化剂能改变化学反应速率
E.任何化学反应都需要催化剂
F.催化剂具有高度的选择性(或专一性)
(3)将质量相同但聚集状态不同的MnO2分别加入15mL 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
催化剂MnO2 | 操作情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
①写出上述实验中发生反应的化学方程式 .
②实验结果表明,催化剂的催化效果与有关.
【答案】
(1)温度;催化剂;其他条件不变时,浓度越大反应速率越大;其他条件不变时,温度越高反应速率越大;其他条件不变时,催化剂能改变反应速率(或正催化剂能加快反应速率);480s﹣720s
(2)BDF
(3)2H2O2 ![]() 2H2O+O2↑;催化剂接触面积
2H2O+O2↑;催化剂接触面积
【解析】解:(1)①根据催化剂的特点“一变二不变”和催化作用(改变反应速率),了解影响化学反应速率的因素有:温度、催化剂、反应物本身的性质、状态等,该研究小组在设计方案时,考虑了浓度、温度、催化剂等因素对过氧化氢分解速率的影响;根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明其他条件不变时,温度越高反应速率越大,但是得到相同气体的时间不同,浓度越大,反应的速度越快;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明其他条件不变时,催化剂能改变反应速率(或正催化剂能加快反应速率),所以答案是:温度、催化剂;其他条件不变时,浓度越大反应速率越大;其他条件不变时,温度越高反应速率越大;其他条件不变时,催化剂能改变反应速率(或正催化剂能加快反应速率);②根据表中数据可知,15%H2O2在无催化剂加热的条件下反应需要480S,而5%H2O2在无催化剂加热的条件下反应需要720S,根据浓度对反应速率的影响可以判断10%H2O2在无催化剂加热的条件下反应所需时间为480s﹣720s,
所以答案是:480s﹣720s;
(2.)A.催化剂参与反应,只是反应前后催化剂的性质和质量都不变,故A错误;
B.催化剂在化学反应前后化学性质和质量都不变,故B正确;
C.催化剂不能使不起反应的物质之间发生反应,故C错误;
D.催化剂能改变化学反应速率,故D正确;
E.有许多化学反应不需要催化剂就能进行,如酸碱中和反应无需催化剂就能快速发生,故E错误;
F.根据催化剂的特点,催化剂具有高度的选择性(或专一性),故F正确;
所以答案是:BDF;
(3.)①H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O2 ![]() 2H2O+O2↑,
2H2O+O2↑,
所以答案是:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
②因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明催化剂接触面积对反应速率有影响,
所以答案是:催化剂接触面积.


科目:高中化学 来源: 题型:
【题目】对金属腐蚀及防护的表述正确的是
A.金属腐蚀的本质:金属失电子发生还原反应
B.牺牲阳极的阴极保护法:被保护的金属应做负极
C.外加电流阴极保护法:被保护的金属应与电源正极相连
D.生铁投入NH4Cl溶液中:主要发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生小陈在实验中不小心将碘水沾在白色实验服上,下面哪种物质的水溶液不能够除掉实验服上的碘水斑迹( )
A.维生素CB.双氧水C.Na2SO3D.SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
A.肼(N2H4)分子中只存在极性共价键
B.该反应中肼作还原剂
C.该反应的反应物总能量高于生成物的总能量
D.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃和烯烃的混合气体的密度是1.07 g·L-1(标准状况),该烷烃和烯烃的体积比是4∶1。这两种烃是
A.CH4、C2H4B.C2H6、C2H4C.CH4、C4H8 D.CH4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.25mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )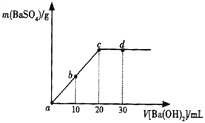
A. 硫酸溶液的体积为25 m L
B. b时刻溶液中SO![]() 的浓度约为0.125 mol·L-1
的浓度约为0.125 mol·L-1
C. d时刻溶液的pH为12
D. 溶液的导电能力:c<d<b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com