
【题目】已知A为常见的金属单质,根据下图所示的关系:

(1)确定A、B、C、F的化学式,A为________,B为________,C为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________。
④________________________________________________。
⑤___________________________________________________。
【答案】Fe Fe3O4 FeCl2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
【解析】
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁。结合转化关系图解答。
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁,B和盐酸反应生成氯化亚铁和氯化铁,根据转化关系分析,D为氯化铁,C为氯化亚铁,E为氢氧化亚铁。则
(1)根据以上分析,A为Fe,B为Fe3O4,C为FeCl2,F为Fe(OH)3;
(2)反应⑧为氢氧化亚铁和氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
反应④为亚铁离子被氯气氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl—;
反应⑤为铁离子变成亚铁离子,离子方程式为:2Fe3++Fe=3Fe2+。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
A.等物质的量的N2和CO所含分子数均为NA
B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的个数为NA
C.1mol OH- 和17g NH3 所含的电子数相等
D.在常温常压下,11.2 L N2 所含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有_____(填序号)。
(3)请配平以下化学方程式:______
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH=
NaOH=![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_____L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成 VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_____。
(5)V2O5 是两性氧化物,与强碱反应生成钒酸盐(阴离子为 VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出 V2O5 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图所示装置模拟工业上生产无水FeCl2的过程。
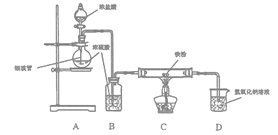
下列说法中正确的是
A. 先点燃C处酒精灯,再打开分液漏斗的活塞
B. 本实验中浓H2SO4体现出吸水性和强氧化性
C. 利用该装置制备FeCl2的原理可表示为:Fe+2HCl![]() FeCl2+H2
FeCl2+H2
D. 装置D适合处理该实验的所有尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中SO2,采用H2O2氧化法检测二氧化硫的含量,并对H2O2的催化分解原理进行分析。
已知:H2O2可看作二元弱酸,它的一级电离常数Ka1=1.55×10-12

Ⅰ.检测二氧化硫的含量
(1)仪器A的名称是_______________。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中过量H2O2溶液充分反应,C中发生反应的化学方程式为__________________________。
(3)用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________(填编号)。向C中所得溶液中滴加几滴酚酞试剂,滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_____g·L-1。
(4)该测定结果比实际值偏高,分析原用可能是_____________(任答一条即可),
(5)本实验中所用的H2O2溶液的浓度,常用KMnO4标准溶液进行测定,H2O2可看作二元弱酸,但一般不利用酸碱中和滴定法过行测定的原因_______________任答一条即可)。
Ⅱ.分析H2O2的催化分解原理
(1)碱性介质中H2O2分解远比酸性介质中快,NaOH可促使H2O2失去质子,请写出H2O2与NaOH溶液反应生成的酸式盐的电子式___________________。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:
2H2O2(aq)=2H2O(l)+O2(g) △H<0
若第一步反应为H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应
则第二步反应为____________△H <0 快反应
(3)能正确的表示I-催化H2O2分解真理的示意图为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(l)钼酸钠晶体(Na2MoO4·2H20)可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。Na2MoO4中Mo的化合价为____。在碱性条件下,将钼精矿(主要成分为MoS2)加入NaClO溶液中,也可以制备钼酸钠,该反应的离子方程式为________。
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
则△H3=_________(用含△H1、△H2的代数式表示)。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。

图1:温度与平衡时气体成分的关系 图2:正、逆反应的平衡常数(K)与温度(T)的关系
①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是____(填序号)。
A.2v正(H2)=v逆(CO)
B.CO体积分数保持不变
C.混合气体的平均相对分子质量不再变化
D.△H不再变化
②图1中A点对应的平衡常数Kp=__(已知A点压强为0.lMPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是____(填“A”或“B”),T1对应的平衡常数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com