
【题目】Ⅰ.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有_____(填序号)。
(3)请配平以下化学方程式:______
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH=
NaOH=![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_____L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成 VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_____。
(5)V2O5 是两性氧化物,与强碱反应生成钒酸盐(阴离子为 VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出 V2O5 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____、_____。
【答案】NaNO2 ②⑤ 10 6 4 10 3 2 11.2 V+6H++5NO3-===VO2++5NO2↑+3H2O Na3VO4 (VO2 ) 2SO4
【解析】
I.(1).在反应2NaNO2+4HI=2NO↑+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高,则氧化剂是NaNO2,故答案为:NaNO2;
(2).由2NaNO2+4HI=2NO↑+I2+2NaI+2H2O可知,鉴别NaNO2和NaCl,可选择碘化钾淀粉试纸、食醋,变蓝的为NaNO2,故答案为:②⑤;
(3).Al元素的化合价从0价升高到+3价,N元素的化合价从+5价降低到0价,由得失电子守恒和原子守恒可知,反应方程式为10Al+6 NaNO3+4NaOH=10 NaAlO2+3N2↑+2 H2O,由化学方程式可知,若反应过程中转移 5 mol 电子,则生成标准状况下N2 的体积为![]() ×
×![]() ×22.4 L/mol=11.2L,故答案为:10 6 4 10 3 2;11.2;
×22.4 L/mol=11.2L,故答案为:10 6 4 10 3 2;11.2;
II.(4).金属钒与浓硝酸反应成VO2+、二氧化氮和水,反应的离子方程式为:V+6H++5NO3=VO2++5NO2↑+3H2O,故答案为:V+6H++5NO3=VO2++5NO2↑+3H2O;
(5).V2O5 是两性氧化物,与强碱反应生成钒酸盐(阴离子为 VO43-),所以V2O5与烧碱溶液反应生成盐的阳离子为钠离子,酸根离子为VO43-,则盐的化学式为Na3VO4;V2O5与稀硫酸溶液反应生成含钒氧离子(VO2+)的盐,所以阳离子是VO2+,阴离子是硫酸根离子,则盐的化学式为(VO2 ) 2SO4,故答案为:Na3VO4;(VO2 ) 2 SO4;


科目:高中化学 来源: 题型:
【题目】向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1 mol 液态H2O2 ,生成液态H2O和氧气放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2(l)+ I-(aq) ![]() H2O(l) +IO-(aq) △H1 反应Ⅰ
H2O(l) +IO-(aq) △H1 反应Ⅰ
H2O2(l)+ IO-(aq)![]() H2O(l) +O2(g)+ I-(aq)△H2 反应Ⅱ
H2O(l) +O2(g)+ I-(aq)△H2 反应Ⅱ
下列有关说法错误的是( )
A. 可以用带火星的木条检验H2O2是否开始分解
B. IO-在反应Ⅰ中是氧化产物,在反应Ⅱ中是氧化剂
C. 在H2O2溶液中加入NaIO也能提高H2O2分解速率
D. △H1+△H2 ![]() -98kJ/mol
-98kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
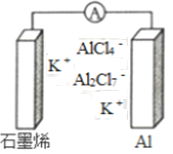
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是

A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:

(1)确定A、B、C、F的化学式,A为________,B为________,C为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________。
④________________________________________________。
⑤___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3和Na2CO3的性质判断正确的是( )
A. 常温下溶解度:NaHCO3>Na2CO3
B. 常温下,相同物质的量浓度溶液的碱性:NaHCO3>Na2CO3
C. 与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3
D. 热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com